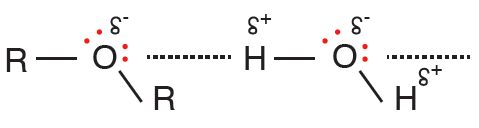|

الإيثرات: مركبات عضوية مشبعة تحمل الصيغة العامة ( R-O-R )، وتعد ذرة الأكسجين ( -O- ) المجموعة الوظيفية في الإيثرات.
تحمل الإيثرات الصيغة الجزيئية العامة:
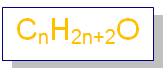
لاحظ أن هذه الصيغة مشابهة للصيغة الجزيئية للكحولات؛ لذا تعد الكحولات والإيثرات متصاوغات.
قواعد التسمية النظامية للإيثرات:
- إذا كانت مجموعتي (R) متشابهتين أضع كلمة ثنائي ثم أسمي مجموعة (R) كما تسمى التفرعات ثم كلمة إيثر.
- إذا كانت مجموعتي (R) مختلفتين أسمي كل مجموعة (R) كما تسمى التفرعات ثم كلمة إيثر.
مثال (1):
أسمي المركب الآتي وفق نظام الأيوباك.
CH3 – O – CH3
يحتوي المركب على مجموعتي (R) متماثلتين.
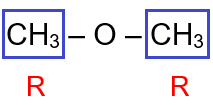
لذا أضع البادئة ثنائي، ثم أسمي مجموعة (R) ثم أضع كلمة إيثر، فيصبح اسم المركب:
ثنائي ميثيل إيثر
مثال (2):
أسمي المركب الآتي وفق نظام الأيوباك.
CH3CH2 – O – CH3
يحتوي المركب على مجموعتي (R) مختلفتين.
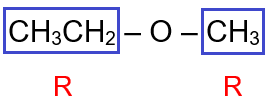
أسمي كل مجموعة (R)، وتكون أولوية التسمية هجائياً باللغة الإنجليزية، ثم أضع كلمة إيثر، فيصبح اسم المركب:
إيثيل ميثيل إيثر
سؤال (1):
أسمي المركبات الآتية وفق نظام الأيوباك.
CH3OCH2CH2CH3 CH3CH2OCH2CH3 C2H5OCH2CH2CH3
سؤال (2):
أكتب الصيغة البنائية للمركب:
بيوتيل إيثيل إيثر.
سؤال (3):
أحدد الخطأ في اسم المركب الآتي، ثم أعد تسميته.
ميثيل إيثيل إيثر.
الخصائص الفيزيائية للإيثرات
الرابطتان ( C - O ) في الإيثر قطبيتان تشكلان منحنى زاوي، وعليه يكون جزيء الإيثر قطبياً، فتترابط جزيئاته بقوى ثنائية القطب.
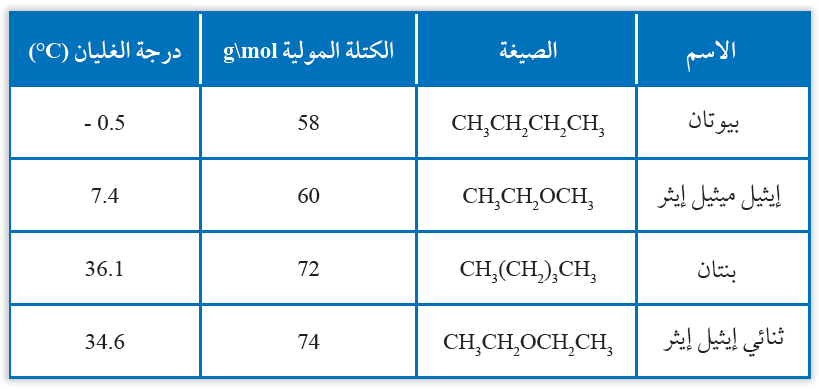
درجات الغليان
عند مقارنة درجة غليان إيثر وألكان متقاربين في الكتلة المولية، نلاحظ تقارب درجتي غليانهما؛ ما يدل على القطبية الضعيفة لجزيئات الإيثر.
الذائبية في الماء
يذوب الإيثر في الماء نظراً لإمكانية تكوين الإيثر روابط هيدروجينية مع الماء، لوجود زوجين من الإلكترونات على ذرة الأكسجين، ولكن ذائبيته أقل من ذائبية الكحولات، ودرجة غليانه أقل من درجة غليان الكحولات.