 |
تحديد المصعد والمهبط في الخلايا الغلفانية
لتحديد المصعد والمهبط في الخلايا الغلفانية من خلال جدول جهود الاختزال اتبع القاعدة البسيطة التالية:
نصف التفاعل الذي يمتلك جهد اختزال أكبر أكثر ميلاً للاختزال فهو بذلك المهبط
سؤال 1 :
اعتماداً على جهود الاختزال المعيارية لأنصاف التفاعلات المبينه في الجدول التالي، أجب عما يأتي:
|
نصف تفاعل الاختزال |
E0 (فولت) |
|
Zn2+ + 2e- → Zn |
-0,76 |
|
Ni2+ + 2e- → Ni |
-0,23 |
|
2H+ + 2e- → H2 |
صفر |
|
Cu2+ + 2e- → Cu |
+0,34 |
- عند عمل خلية غلفانية مكونة من قطبي الخارصين والهيدروجين، أي القطبين المهبط؟
- عند عمل خلية غلفانية مكونة من قطبي النحاس والهيدروجين، أي القطبين المهبط؟
- عند عمل خلية غلفانية مكونة من قطبي الخارصين والنحاس، أي القطبين المهبط؟
- مع أي الأقطاب يسلك النيكل كمصعد؟
سؤال 2 :
اعتماداً على جهود اختزال كل من الكادميوم والكروم، أجب عن الأسئلة التالية والمتعلقة بالخلية الغلفانية المكونة من قطبي الكادميوم والكروم ومحاليل أيوناتهما:
E0 = -0,40 فولت Cd2+ + 2e- → Cd
E0 = -0,73 فولت Cr3+ + 3e- → Cr
- أي القطبين يمثل المصعد، وما شحنته؟
- أي القطبين يمثل المهبط وما شحنته؟
- وضح اتجاه حركة الإلكترونات في الدارة الخارجية.
- إلى أي الأقطاب يتجه مؤشر الفولتميتر في الخلية؟
- ماذا يحدث لكتلة قطب الكادميوم؟
- ماذا يحدث لكتلة قطب الكروم؟
- ماذا يحدث لتركيز أيونات الكروم في المحلول؟
- اكتب معادلة التفاعل الذي يحدث عند كل قطب.
- اكتب معادلة التفاعل الكلي الموزون.
سؤال 3 :
تم ربط قطب الهيدروجين المعياري بقطب رصاص مغموس في محلول PbSO4 (1مول/لتر)، ويتصل المحلولان بقنطرة ملحية، وقد تبين عملياً أن جهد الخلية المعياري (E0) = 0,13 فولت، وأن مؤشر الفولتميتر يتجه ناحية قطب الهيدروجين. أجب عن الأسئلة التالية:
- أي القطبين يمثل المصعد وأيهما يمثل المهبط، وما شحنة كل منهما؟
- اكتب معادلة نصف التفاعل الذي يحدث عند كل قطب.
- ماذا يحدث لتركيز أيونات Pb2+ في المحلول؟
- وضح اتجاه حركة الإلكترونات في الأسلاك.
- ما قيمة جهد التأكسد للرصاص متضمناً الإشارة؟
سؤال 4 :
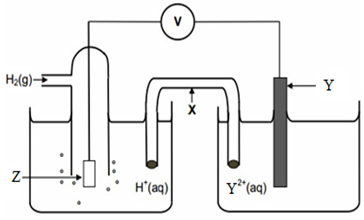 الشكل الآتي يمثل خلية غلفانية في الظروف المعيارية، فإذا علمت أن القطب (Y) تزداد كتلته عند مرور التيار الكهربائي في الأسلاك، وأن قراءة الفولتميتر = 0,70 فولت، أجب عن الأسئلة التي تلي الشكل:
الشكل الآتي يمثل خلية غلفانية في الظروف المعيارية، فإذا علمت أن القطب (Y) تزداد كتلته عند مرور التيار الكهربائي في الأسلاك، وأن قراءة الفولتميتر = 0,70 فولت، أجب عن الأسئلة التي تلي الشكل:
- أي القطبين يمثل المهبط، وما شحنته؟
- ما قيمة جهد تأكسد القطب (Y)؟
- اكتب أنصاف التفاعلات التي تحدث على كل قطب.
- ما الذي يمثله الرمز (X)، وما أهميته للخلية؟
- ما الذي يمثله الرمز (Z)؟
- عند وضع قطب فلزي رمزه (M) بدلاً من القطب الهيدروجين، فأي القطبين يمثل المصعد إذا علمت أن جهد اختزال (M) = -0,40 فولت؟