 |
تركيب لويس النقطي
Lewis Dot Structure
بما أن إلكترونات التكافؤ، والموجودة في مستوى الطاقة الخارجي للذرات هي التي تحدد الخصائص الكيميائية للذرة، فقد توصل العلماء إلى نموذج بسيط للذرة يوضح عدد إلكترونات التكافؤ، ويسمى هذا التمثيل تركيب لويس النقطي.
تركيب لويس النقطي: نموذج يكون فيه رمز ذرة العنصر محاطاً بنقاط تمثل عدد إلكترونات التكافؤ.
خطوات رسم تركيب لويس النقطي للذرات
- أكتب رمز العنصر.
- أحدد عدد إلكترونات التكافؤ.
- أعبر عن كل إلكترون تكافؤ بنقطة توزع حول رمز ذرة العنصر، بحيث توزع النقاط الأربع الأولى توزيعاً منفرداً.
- إذا زاد عدد إلكترونات التكافؤ عن أربعة، أوزع النقاط المتبقية بحيث تصبح النقاط على شكل أزواج.
مثال (1):
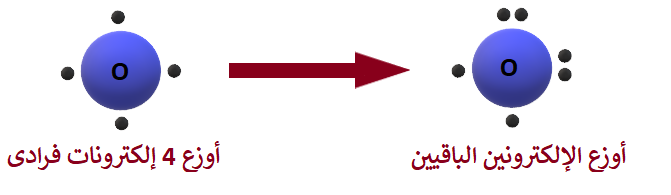
التوزيع الإلكتروني لذرة الأكسجين (8O)، هو:
8O: 2 , 6
عدد إلكترونات التكافؤ (المستوى الخارجي) يساوي (6) إلكترونات.
أوزع (4) إلكترونات فرادى، ثم أوزع الإلكترونين الأخيرين بحيث تصبح الإلكترونات على شكل أزواج.
مثال (2):
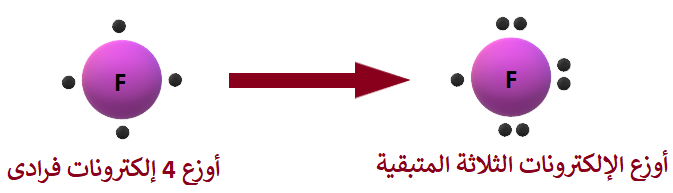
التوزيع الإلكتروني لذرة الأكسجين (9F)، هو:
9F: 2 , 7
عدد إلكترونات التكافؤ (المستوى الخارجي) يساوي (7) إلكترونات.
أوزع (4) إلكترونات فرادى، ثم أوزع الإلكترونات الثلاثة المتبقية بحيث تصبح الإلكترونات على شكل أزواج.
خطوات رسم تركيب لويس النقطي لأيونات الذرات
- أكتب رمز العنصر.
- إذا كان الأيون موجباً، أحذف نقاطاً بمقدار شحنة الأيون، وأكتب شحنة الأيون أعلى رمز العنصر.
- إذا كان الأيون سالباً، أضيف نقاطاً بمقدار شحنة الأيون، وأكتب شحنة الأيون أعلى رمز العنصر.
مثال (1):
التوزيع الإلكتروني لذرة الصوديوم (11Na)، هو:
11Na: 2 , 8 , 1
أضع نقطة فوق رمز ذرة الصوديوم إذا أردت تمثيل ذرة الصوديوم بتركيب لويس، وإذا أردت تمثيل أيون الصوديوم (Na+)، أزيل النقطة، وأكتب شحنة الأيون فوق الرمز.

مثال (2):
التوزيع الإلكتروني لذرة الكبريت (16S)، هو:
16S: 2 , 8 , 6
أضع (6) نقاط فوق رمز ذرة الكبريت إذا أردت تمثيل ذرة الكبريت بتركيب لويس، وإذا أردت تمثيل أيون الكبريت (S2-)، أضيف نقطتين، وأكتب شحنة الأيون فوق الرمز.
