 |
الاتزان في محاليل الحموض الضعيفة
Equilibrium of Weak Acids
- تتأين الحموض الضعيفة في الماء جزئياً في الماء، ويعبر عن ثابت الاتزان لمحاليل الحموض الضعيفة بدلالة ثابت تأين الحمض الضعيف (Ka).
- ينزاح الاتزان في محاليل الحموض الضعيفة جهة اليسار (نحو المتفاعلات)، وهذا يعني أن القاعدة المرافقة الناتجة من تأين الحمض له قدرة على الارتباط مع البروتون لإعادة تكوين المتفاعلات.
- يكون تركيز الحمض أعلى بكثير من تراكيز الأيونات الناتجة عن تأينه.
فإذا رمزنا للحمض الضعيف بالرمز HA ، فإن معادلة تأين الحمض تكتب كالآتي:
HA + H2O A- + H3O+
يعبر عن ثابت تأين الحمض الضعيف كالآتي:
Ka =
ولكل حمض ضعيف ثابت تأين عند درجة (25oC)، ويستخدم:
1- لمقارنة قدرة الحمض على التأين.
2- حساب تركيز H3O+ في محلول الحمض الضعيف.
ولمقارنة حمضين ضعيفين:
بزيادة قيمة Ka للحمض، يزداد تأينه في الماء، فيزداد تركيز أيون الهيدرونيوم في محلوله، ويقل تركيز أيون الهيدروكسيد في محلوله، وتقل قيمة pH في محلوله.

الحسابات في محاليل الحموض الضعيفة
لنرفض أن لدينا حمضاً ضعيفاً ولنرمز له بالرمز (HA).

أكتب قانون ثابت تأين الحمض:
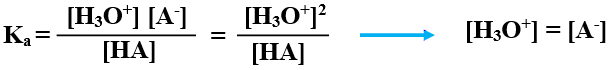
أعوض التراكيز عند الاتزان:
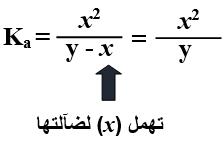
وبالضرب التبادلي تصبح العلاقة:
x2 = Ka . y
وبأخذ جذر الطرفين نحسب قيمة (x) والتي تساوي تركيز أيون الهيدرونيوم.
x =
وعليه يمكن إطلاق التعميم التالي:
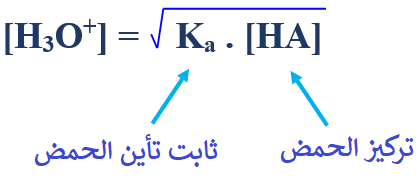
مثال (1):
أحسب تركيز أيونات H3O+ في محلول حمض الإيثانويك CH3COOH، الذي تركيزه 0.1 M علماً أن Ka = 1.7 x 10-5
الحل:
أكتب معادلة تأين الحمض:
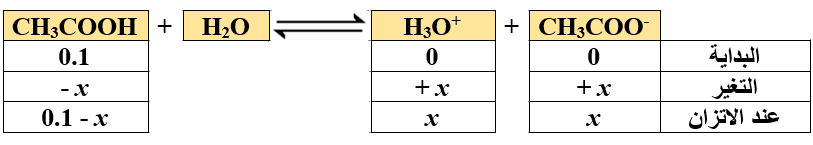
أكتب تعبير Ka :
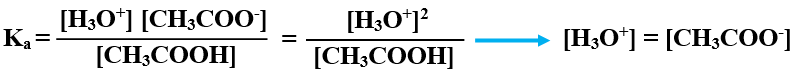
أعوض التراكيز عند الاتزان، وقيمة Ka :

x2 = 1.7 x 10-5 x 0.1 = 1.7 x 10-6
وبأخذ جذر الطرفين:
x = [H3O+] = = 1.3 x 10-3 M
مثال (2):
أحسب الرقم الهيدروجيني لمحلول حمض البنزويك C6H5COOH تركيزه 2 M
علماً أن Ka = 6.3 x 10-5 , log 1.12 = 0.05
الحل:
أكتب معادلة تأين الحمض:
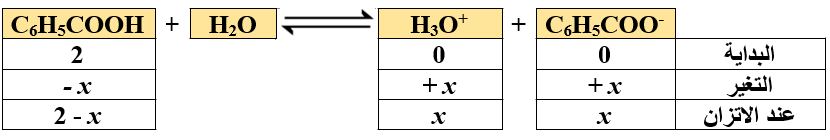
أكتب تعبير Ka :
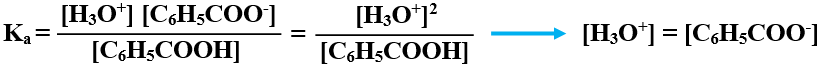
أعوض التراكيز عند الاتزان، وقيمة Ka :
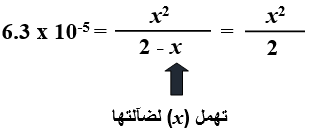
x2 = 6.3 x 10-5 x 2 = 1.26 x 10-4
وبأخذ جذر الطرفين:
x = [H3O+] = = 1.12 x 10-2 M
أحسب قيمة الرقم الهيدروجيني من تركيز الهيدرونيوم:
pH = - log [H3O+]
pH = - log (1.12 x 10-2) = 2 – log 1.12 = 2 – 0.05 = 1.95
سؤال (1):
يبين الجدول التالي قيم ثوابت التأين (Ka) لبعض الحموض الضعيفة عند درجة 25oC، أدرس الجدول ثم أجيب عن الأسئلة التي تليه:
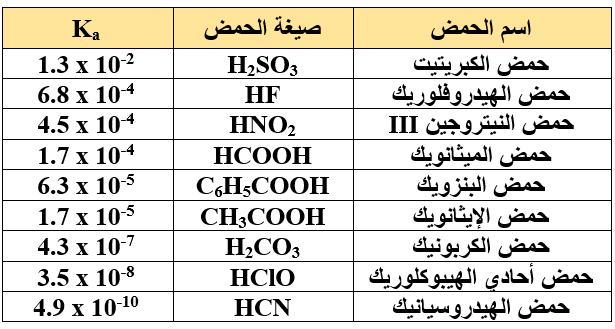
- أكتب صيغة الحمض الأقوى والحمض الأضعف في الجدول، ثم أكتب صيغة القاعدة المرافقة لكل منهما.
- أي محلولي الحمضين: H2CO3 أم HNO2المتساويين في التركيز يكون تركيز H3O+ أعلى؟
- أيهما له أعلى رقم هيدروجيني: محلول HF أم HClO (لهما التركيز نفسه)؟
- أيّ الحمضين: HCOOH أم C6H5COOH أكثر تأيناً في الماء؟
- هل تتوقع أن تكون قيمة pH لمحلول حمض الإيثانويك الذي تركيزه 0.01 M أكبر أم أقل من 2 ؟ ولماذا؟
سؤال (2):
أحسب قيمة pH في محلول حمض الميثانويك HCOOH بتركيز 0.1 M
علماً أنّ: Ka = 1.6 x 10-4 , log 4 = 0.6
سؤال (3):
يبين الجدول التالي قيم ثوابت التأين (Ka) لحمضين، أجيب عن الأسئلة الآتية:
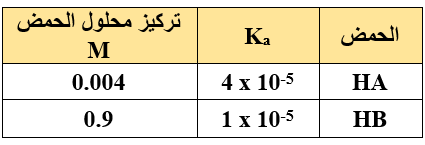
- أي الحمضين أقوى؟
- أي الحمضين أقل تأيناً في الماء؟
- في أي محلولي الحمضين يكون تركيز أيون الهيدرونيوم أعلى؟
- أي محلولي الحمضين أعلى pH ؟
سؤال (4):
يبين الجدول الآتي تركيز أيون الهيدروكسيد لأربعة حموض ضعيفة متساوية التركيز. أدرس الجدول ثم أجيب عن الأسئلة الآتية:
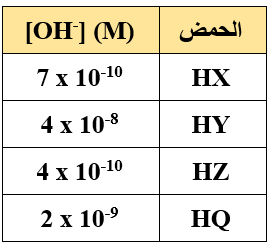
- أكتب صيغة الحمض الأقوى.
- أكتب صيغة القاعدة المرافقة في محلول الحمض الأضعف.
- أكتب صيغة القاعدة المرافقة للحمض الذي يمتلك محلوله قيمة pH أعلى.
- ما القاعدة المرافقة لكل من الحموض المذكورة؟
- أي محاليل الحموض المذكوره تمتلك قيمة pH أقل؟
- أرتب الحموض الموجودة في الجدول حسب قدرتها على التأين.
- أي محاليل الحموض يوصل التيار الكهربائي بشكل أكبر؟
- أي محلولي الحمضين: ( HX أم HQ ) يمتلك [H3O+] أقل؟
- أكتب صيغ الدقائق الموجودة في محلول HZ عند الاتزان.
سؤال (5):
أحسب قيمة الرقم الهيدروجيني pH لمحلول HF تركيزه 0.05 M. (log 6 = 0.78)
علماً بأن ثابت تأين الحمض (Ka) يساوي 7.2 x 10-4
سؤال (6):
أحسب تركيز محلول حمض HNO2 الذي رقمه الهيدروجيني pH 2.53
علماً أن ثابت تأين الحمض (Ka) يساوي 4.5 x 10-4 . (log 3 = 0.47)
سؤال (7):
أحسب قيمة Ka للحمض الضعيف HZ إذا كان الذي تركيز محلوله 0.2 M، ورقمه الهيدروجيني يساوي (4).
سؤال (8):
الجدول أدناه يمثل ثلاثة محاليل مائية لثلاثة حموض ضعيفة برموز افتراضية:
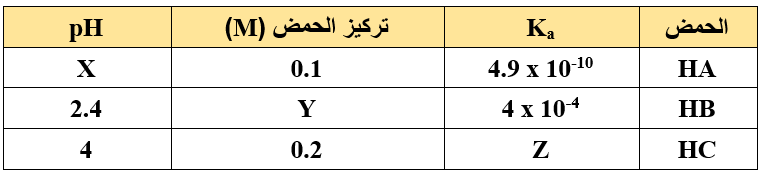
معتمداً على المعلومات الواردة في الجدول، أجد قيم كل من (X)، (Y)، (Z). (log 7 = 0.85 , log 4 = 0.6)
سؤال (9):
محلول الحمض الضعيف HY تركيزه 1 M، وتركيز أيون H3O+ فيه 2 x 10-2 M، أحسب قيمة pH لمحلول تركيزه 0.01 M من الحمض HY . (log 2 = 0.3)
سؤال (10):
أذيب 1.22 g من حمض البنزويك (C6H5COOH) في لتر من الماء فتبين أن [H3O+] يساوي 8 x 10-4 M أحسب قيمة Ka
(الكتلة المولية للحمض Mr = 122 g/mol).
سؤال (11):
يبين الجدول أدناه بعض محاليل الحموض الضعيفة بتركيز 0.01 M لكل منها، ومعلومات عن كل محلول. أجيب عن الأسئلة التي تليه:
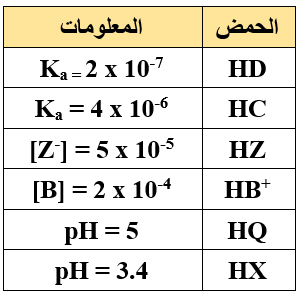
- أي الحمضين: HD أم HC هو الأقوى؟
- أي محلولي الحمضين: HZ أم HB+ يمتلك [OH-] أعلى؟
- أي الحمضين: HQ أم HX يمتلك قيمة Ka أعلى؟
- أي محلولي الحمضين: HQ أم HZ يمتلك قيمة pH أقل؟
- أي الحمضين: HX أم HZ أكثر تأيناً في الماء؟
- كم تبلغ قيمة pH لمحلول الحمض HB+ ؟ (log 2 = 0.3)
- كم تبلغ قيمة pH لمحلول الحمض HB+ تركيزه (1 M)؟
(log 2 = 0.3)
سؤال (12):
يبيّن الجدول الآتي عدداً من محاليل الحموض الافتراضية الضعيفة متساوية التركيز (0.1 M) وقيم pH لها، أدرس الجدول، ثمّ أجيب عن الأسئلة التي تليه:

- أي الحمضين أقوى: HY أم HQ ؟
- أكتب معادلة تفاعل Y- مع H2A .
- أكتب معادلة تفاعل HB- مع الماء.
- أي حموض الجدول يمتلك قيمة Ka أعلى؟
- كم تبلغ قيمة Ka للحمض HZ ؟
- ما صيغة القاعدة المرافقة لكل من الحمضين H2A و XH+ ؟
سؤال (13):
أرتب محاليل الحموض التالية تصاعدياً وفق زيادة قيمة pH إذا كانت تراكيزها متساوية:
CH3COOH (Ka = 1.8 x 10-5) ، HCl ، HCOOH (Ka = 1.7 x 10-4)