 |
تحديد المصعد والمهبط في الخلايا الجلفانية
لتحديد المصعد والمهبط في الخلايا الغجلفانية من خلال جدول جهود الاختزال اتبع القاعدة البسيطة التالية:
نصف التفاعل الذي يمتلك جهد اختزال أكبر أكثر ميلاً للاختزال فهو بذلك المهبط
مثال:
خلية جلفانية مكونة من نصف خلية الرصاص Pb2+│Pb ونصف خلية الألمنيوم Al3+│Al في الظروف المعيارية. أحدد المهبط والمصعد في الخلية الجلفانية، وأكتب المعادلة الكلية، إذا علمت أن:
Pb2+ (aq) + 2e- → Pb (s) EoPb = - 0.13 V
Al3+ (aq) + 3e- → Al (s) EoAl = - 1.66 V
الحل:
بما أن جهد اختزال الرصاص أعلى من جهد اختزال الألمنيوم، فهذا يعني أن ميل أيونات الرصاص للاختزال أعلى من ميل أيونات الألمنيوم للاختزال، وعليه يكون قطب الرصاص هو المهبط، وقطب الألمنيوم هو المصعد.
أقلب معادلة الألمنيوم وأساوي الإلكترونات بالضرب التبادلي وأجمع المعادلتين:
3Pb2+ (aq) + 2Al (s) → 3Pb (s) + 2Al3+ (aq)
سؤال 1 :
اعتماداً على جهود الاختزال المعيارية لأنصاف التفاعلات المبينه في الجدول التالي، أجب عما يأتي:
|
نصف تفاعل الاختزال |
Eo (فولت) |
|
Zn2+ + 2e- → Zn |
-0.76 |
|
Ni2+ + 2e- → Ni |
-0.23 |
|
2H+ + 2e- → H2 |
0 |
|
Cu2+ + 2e- → Cu |
+0.34 |
1- عند عمل خلية جلفانية مكونة من قطبي الخارصين والهيدروجين، أي القطبين المهبط؟
2- عند عمل خلية جلفانية مكونة من قطبي النحاس والهيدروجين، أي القطبين المهبط؟
3- عند عمل خلية جلفانية مكونة من قطبي الخارصين والنحاس، أي القطبين المهبط؟
4- مع أي الأقطاب يسلك النيكل كمصعد؟
سؤال 2 :
اعتماداً على جهود اختزال كل من الكادميوم والكروم، أجب عن الأسئلة التالية والمتعلقة بالخلية الجلفانية المكونة من قطبي الكادميوم والكروم ومحاليل أيوناتهما:
Eo = -0.40 V Cd2+ + 2e- → Cd
E0 = -0.73 V Cr3+ + 3e- → Cr
1- أي القطبين يمثل المصعد، وما شحنته؟
2- أي القطبين يمثل المهبط وما شحنته؟
3- أوضح اتجاه حركة الإلكترونات في الدارة الخارجية.
4- إلى أي الأقطاب يتجه مؤشر الفولتميتر في الخلية؟
5- ماذا يحدث لكتلة قطب الكادميوم؟
6- كيف تتحرك الأيونات السالبة في القنطرة الملحية؟
7- ماذا يحدث لتركيز أيونات الكروم في المحلول؟
8- أكتب معادلة التفاعل الذي يحدث عند كل قطب.
9- أكتب معادلة التفاعل الكلي الموزون.
سؤال 3 :
تم ربط قطب الهيدروجين المعياري بقطب رصاص مغموس في محلول PbSO4 (1 M)، ويتصل المحلولان بقنطرة ملحية، وقد تبين عملياً أن جهد الخلية المعياري = 0.13 V (Eocell)، وأن مؤشر الفولتميتر يتجه ناحية قطب الهيدروجين. أجب عن الأسئلة التالية:
1- أي القطبين يمثل المصعد وأيهما يمثل المهبط، وما شحنة كل منهما؟
2- أكتب معادلة نصف التفاعل الذي يحدث عند كل قطب.
3- ماذا يحدث لتركيز أيونات Pb2+ في المحلول؟
4- أوضح اتجاه حركة الإلكترونات في الأسلاك.
5- ما قيمة جهد التأكسد للرصاص متضمناً الإشارة؟
سؤال 4 :
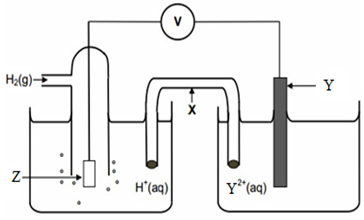 الشكل الآتي يمثل خلية جلفانية في الظروف المعيارية، فإذا علمت أن القطب (Y) تزداد كتلته عند مرور التيار الكهربائي في الأسلاك، وأن قراءة الفولتميتر = 0.70V، أجب عن الأسئلة التي تحاذي الشكل:
الشكل الآتي يمثل خلية جلفانية في الظروف المعيارية، فإذا علمت أن القطب (Y) تزداد كتلته عند مرور التيار الكهربائي في الأسلاك، وأن قراءة الفولتميتر = 0.70V، أجب عن الأسئلة التي تحاذي الشكل:
1- أي القطبين يمثل المهبط، وما شحنته؟
2- ما قيمة جهد تأكسد القطب (Y)؟
3- أكتب أنصاف التفاعلات التي تحدث على كل قطب.
4- ما الذي يمثله الرمز (x)، وما أهميته للخلية؟
5- ما الذي يمثله الرمز (Z)؟
6- عند وضع قطب فلزي رمزه (M) بدلاً من القطب الهيدروجين، فأي القطبين يمثل المهبط إذا علمت أن جهد اختزال (M) = + 0.5 V ؟