 |
أسئلة وزارية (التأكسد والاختزال)
الدورات (1997-2000)
دورة 1997
أ- انقل الإجابة الصحيحة للفقرة الآتية إلى دفتر إجابتك.
1- يكون عدد تأكسد الكروم (Cr) في الصيغة الكيميائية Cr2O72-:
أ- (-2)
ب- (+2)
ج- (+6)
د- (+7)
2- العبارة التي تتفق وخلية التحليل الكهربائي:
أ- شحنة المهبط موجبة.
ب- التفاعل الكلي تلقائي.
ج- تفاعل الاختزال يحدث عند المصعد.
د- جهد الخلية (Eo) له قيمة سالبة.
ب- حدد كلاً من العامل المؤكسد والعامل المختزل في المعادلة الآتية:
H2S + HNO3 → S + NO + H2O
العامل المؤكسد: HNO3
العامل المختزل: H2S
ج- وازن المعادلة الأيونية الآتية بطريقة نصف التفاعل (وسط حمضي):
MnO4-(aq) + C2O42-(aq) → Mn2+(aq) + CO2(g)
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O ……… (1)
C2O42- → 2CO2 + 2e- ……… (2)
بضرب المعادلة (1) في 2 والمعادلة (2) في 5
2MnO4- + 16H+ + 10e- → 2Mn2+ + 8H2O
5C2O42- → 10CO2 + 10e-
بجمع المعادلتين بعد حذف الإلكترونات:
2MnO4- + 16H+ + 5C2O42- → 2Mn2+ + 10CO2 + 8H2O
د-  اعتماداً على جهود الاختزال المعيارية لأنصاف التفاعلات المبينة في الجدول الآتي. أجب عما يأتي:
اعتماداً على جهود الاختزال المعيارية لأنصاف التفاعلات المبينة في الجدول الآتي. أجب عما يأتي:
1- عند وصل نصف خلية من الفضة (Ag) مع نصف خلية آخر من النيكل (Ni) لعمل خلية جلفانية:
أ- اكتب معادلة نصف التفاعل الذي يحدث عند كل قطب.
نصف تفاعل المصعد: Ni → Ni2+ + 2e-
نصف تفاعل المهبط: 2Ag+ + 2e- → 2Ag
ب- أي القطبين المصعد؟ وما شحنته؟.
المصعد هو قطب (Ni) وشحنته سالبة.
ج- احسب قيمة جهد هذه الخلية (oE).
Eocell = Eo(cathode) – Eo(anode)
Eocell = 0.80 – (- 0.23) = + 1.03 V
2- هل يمكن حفظ محلول كبريتات النيكل في وعاء من الألمنيوم؟ فسر إجابتك مستعيناً بجهود الاختزال.
3NiSO4 + 2Al → Al2(SO4)3 + 3Ni
نلاحظ من التفاعل المراد التنبؤ بحدوثه أن الألمنيوم تأكسد (مصعد)، ويحسب (Eo) للتفاعل كالتالي:
Eocell = Eo(cathode) – Eo(anode)
Eocell = - 0.23 – (-1.66) = + 1.43 V
وبما أن (Eo) للتفاعل له قيمة موجبة فهذا يعني أن التفاعل يحدث بصورة تلقائية؛ إذاً لا يمكن حفظ المحلول.
دورة 1998
أ- انقل الإجابة الصحيحة للفقرة الآتية إلى دفتر إجابتك.
1- عدد تأكسد الكبريت (S) في الأيون S2O32- يساوي:
أ- +2
ب- +3
ج- +4
د- -4
2- عند التحليل الكهربائي لمحلول مائي ليوديد البوتاسيوم KI باستخدام أقطاب جرافيت، فإن ما يحدث عند المهبط هو:
أ- ترسب اليود.
ب- ترسب البوتاسيوم.
ج- انطلاق غاز الهيدروجين.
د- انطلاق غاز الأكسجين.
ب- خلية جلفانية يحدث فيها التفاعل الآتي:
Ni (s) + Cu2+ (aq) → Ni2+ (aq) + Cu (s)
فإذا علمت أن جهد هذه الخلية (oE) يساوي (0.57 V) أجب عما يلي:
1- حدد القطب الذي يمثل المهبط والقطب الذي يمثل المصعد؟ وما شحنة كل منهما؟
المهبط (Cu) وشحنته (+) المصعد (Ni) وشحنته (-).
2- حدد اتجاه سريان الإلكترونات في الدارة الخارجية لهذه الخلية؟
تتحرك الإلكترونات من قطب (Ni) إلى قطب (Cu).
3- إذا علمت أن جهد اختزال النحاس oE = +0.34 V احسب جهد اختزال النيكل.
Eocell = Eo(cathode) – Eo(anode)
0.57 = 0.34 – E0(anode)
Eo(anode) = - 0.23 V
ج- الجدول التالي يمثل قيم جهود الاختزال المعياري (oE) لعدد من الفلزات:

1- أي من الفلزات السابقة يعتبر الأقوى كعامل مختزل؟
Mg
2- أي منها لا يذوب في محلول HCl؟
Cu , Ag
3- سمّ الفلزين اللذين يكونان خلية جلفانية بأكبر فولتية.
Mg – Ag
د- وازن المعادلة الأيونية الآتية بطريقة نصف التفاعل في وسط قاعدي، ثم حدد كلاً من العامل المؤكسد والعامل المختزل فيها:
MnO4-1 + ClO2-1 → MnO2 + ClO4-1
MnO4-1 + 4H+ + 3e- → MnO2 + 2H2O …… (1)
ClO2-1 + 2H2O → ClO4-1 + 4H+ + 4e- …… (2)
بضرب المعادلة (1) في 4 والمعادلة (2) في 3 وجمع المعادلتين:
4MnO4-1 + 16H+ + 12e- → 4MnO2 + 8H2O
3ClO2-1 + 6H2O → 3ClO4-1 + 12H+ + 12e-
4MnO4-1 + 3ClO2-1 + 4H+ → 4MnO2 + 3ClO4-1 + 2H2O
وبإضافة 4OH- إلى طرفي المعادلة:
4MnO4-1 + 3ClO2-1 + 4H+ + 4OH- → 4MnO2 + 3ClO4-1 + 2H2O + 4OH-
4MnO4-1 + 3ClO2-1 + 4H2O → 4MnO2 + 3ClO4-1 + 2H2O + 4OH-
4MnO4-1 + 3ClO2-1 + 2H2O → 4MnO2 + 3ClO4-1 + 4OH-
هـ- أمّر تيار كهربائي في محلول NaCl باستخدام أقطاب خاملة:
- اكتب معادلة التفاعل الذي يحدث عند المصعد.
2Cl- → Cl2 + 2e-
دورة 1999
أ- انقل الإجابة الصحيحة للفقرة الآتية إلى دفتر إجابتك.
1- عدد تأكسد اليود في الأيون H3IO62- يساوي:
أ- +7
ب- -7
ج- +1
د- -1
2- إذا تم تحليل مصهور هيدريد الليثيوم (LiH) كهربائياً باستخدام أقطاب بلاتين، فإن تفاعل المصعد هو:
أ- Li+ + e- → Li
ب- Li → Li+ + e-
ج- 2H - → H2 + 2e-
د- 2H+ + 2e- → H2
ب- 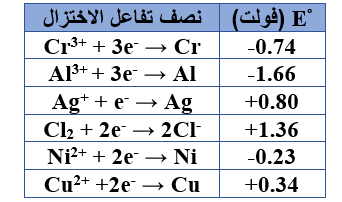 ادرس جهود الاختزال المعيارية لأنصاف التفاعلات المبينة في الجدول المجاور، ثم أجب عن الأسئلة الآتية:
ادرس جهود الاختزال المعيارية لأنصاف التفاعلات المبينة في الجدول المجاور، ثم أجب عن الأسئلة الآتية:
1-حدد العامل المؤكسد الأقوى.
Cl2
2- هل يمكن حفظ محلول AgNO3 في وعاء من الألمنيوم (Al)؟
لا يمكن.
3- اكتب عنصراً واحداً منها يسبب انطلاق غاز H2 من محاليل الحموض المخففة.
Cr , Ni , Al
ج- خلية كهركيميائية تتكون من قطبي Cr ، Ni وأيوناتهما.
1-حدد المهبط وإشارته.
المهبط (Ni) وإشارته (+).
2- اكتب معادلة التفاعل الكلي.
2Cr + 3Ni2+ → 2Cr3+ + 3Ni
3- احسب جهد الخلية (Eo).
E0cell = E0(cathode) – E0(anode)
E0cell = -0.23 – (- 0.74) = +0.51 V
د- وازن المعادلة الآتية بطريقة نصف التفاعل في وسط قاعدي:

C2H4O + Cu+2 → C2H3O2- + Cu2O
2Cu+2 + H2O + 2e- → Cu2O + 2H+ …… (1)
C2H4O + H2O → C2H3O2- + 3H+ + 2e- …… (2)
بجمع المعادلتين:
C2H4O + 2Cu+2 + 2H2O → C2H3O2- + Cu2O + 5H+
وباضافة 5OH- للطرفين:
+ C2H4O + 2Cu+2 + 2H2O → C2H3O2- + Cu2O + 5H+ + 5OH- 5OH-
+ C2H4O + 2Cu+2 + 2H2O → C2H3O2- + Cu2O + 5H2O 5OH-
+ C2H4O + 2Cu+2 → C2H3O2- + Cu2O + 3H2O 5OH-
هـ- وضح المقصود بالتأكسد والاختزال الذاتي؟
تفاعل التأكسد والاختزال الذاتي: سلوك المادة كعامل مؤكسد وعامل مختزل في التفاعل نفسه.
دورة 2000
أ- انقل الإجابة الصحيحة للفقرات الآتية إلى دفتر إجابتك.
1- يكون المصعد في الخلية الجلفانية هو القطب:
أ- السالب الذي تحدث عنده عملية التأكسد.
ب- السالب الذي تحدث عنده عملية الاختزال.
ج- الموجب الذي تحدث عنده عملية التأكسد.
د- الموجب الذي تحدث عنده عملية الاختزال.
2-عند التحليل الكهربائي لمصهور كلوريد الصوديوم (NaCl)، فإن عدد مولات الصوديوم الناتجة إلى عدد مولات غاز الكلور المتصاعدة يساوي:
أ- 0.5
ب- 1
ج- 2
د- 2
ب- تم استخدام عدد من الأقطاب الفلزية ومحاليها المائية (1 M) لعمل خلايا جلفانية مختلفة في الظروف المعيارية، كما في الجدول (1)، كما يبين الجدول (2) جهود الاختزال المعيارية لعدد من أنصاف التفاعلات:
اعتماداً على المعلومات في الجدولين: (1,2) ، أجب عما يأتي:

1- أي القطبين (A أم B) يمثل المصعد في الخلية رقم (1)؟
(B) وشحنته (-).
2- ما رقم الخلية التي لها أقل قيمة جهد (oE).
الخلية رقم (2).
3- ماذا يحدث لكتلة القطب (B) في الخلية رقم (3)؟
تزداد.
4- أي الأيونات (Al3+ , Ni2+ , Ag+) أقوى كعامل مؤكسد؟
Ag+
5- باستخدام الجدول (2) اختر فلزين لعمل خلية لها أعلى جهد Eo ، واكتب معادلة التفاعل الكلي لهذه الخلية.
Ag/Al
Al + 3Ag+ → Al3+ + 3Ag
ج- يتم التفاعل الآتي في وسط حمضي، أجب على الأسئلة التي تليه
HSO3- + IO3- → SO42- + I2
1- وازن المعادلة بطريقة نصف التفاعل.
2IO3- + 12H+ + 10e- → I2 + 6H2O …… (1)
HSO3- + H2O → SO42- + 3H+ + 2e- …… (2)
بضرب المعادلة (1) في 1 والمعادلة (2) في 5 وجمع المعادلتين:
1x (2IO3- + 12H+ + 10e- → I2 + 6H2O)
5 x (HSO3- + H2O → SO42- + 3H+ + 2e-)
2IO3- + 12H+ + 10e- → I2 + 6H2O
5HSO3- + 5H2O → 5SO42- + 15H+ + 10e-
2IO3- + 5HSO3- → I2 + 5SO42- + H2O + 3H+
2- حدد العامل المؤكسد.
IO3-
3- ما عدد تأكسد اليود في الأيون (IO3-)؟
+5
د- مّر تيار في خلية التحليل الكهربائي للماء باستخدام حمض الكبريتيك H2SO4 وأقطاب من البلاتين.
اكتب المعادلة الموزونة للتفاعل الذي يحدث عند المصعد.
2H2O → O2 + 4H+ + 4e-