 |
أسئلة وزارية (الحموض والقواعد)
الدورات (2016-2019)
الدورة الشتوية 2016
أ) يبين الجدول الآتي عدداً من محاليل الحموض والقواعد الضعيفة ومعلومات عنها، ادرسه جيداً ثم أجب عن الأسئلة الآتية:
(Kw = 1 x 10-14 , log 5 = 0.7 , log 4 = 0.6)
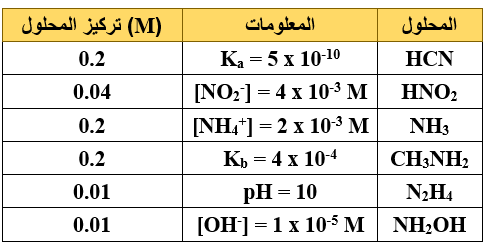
1- احسب تركيز H3O+ لمحلول HCN .
HCN + H2O CN- + H3O+
Ka = =
5 x 10-10 =
[H3O+] = = 1 x 10-5 M
pH = -log [H3O+] = - log (1 x 10-5) = 5
2- ما صيغة الحمض المرافق الأضعف؟
CH3NH3+
3- احسب pH لمحلول NH3 .
[NH4+] = [OH-] = 2 x 10-3 M
[H3O+] = = = 0.5 x 10-11 = 5 x 10-12 M
pH = -log [H3O+] = -log (5 x 10-12) = 11.3
4- أي الحمضين له أعلى قيمة pH HCN أم HNO2 ؟
HCN
5- اكتب صيغة الحمض المرافق للقاعدة NH2OH .
NH2OH2+
6- في المعادلة الآتية:
N2H4 + NH4+ N2H5+ + NH3
أ- حدّد الزوجين المترافقين من الحمض والقاعدة.
(N2H4/N2H5+) , (NH4+/NH3)
ب- حدّد الجهة التي يرجحها الاتزان.
يرجح الاتزان جهة المتفاعلات.
ب) تم تحضير محلول مكون من القاعدة B والملح BHNO3 بالتركيز نفسه، فإذا كان تركيز= 2 x 10-9 M H3O+ ، أجب عمّا يلي: (log 5 = 0.7 , Kw = 1 x 10-14)
1- ما صيغة الأيون المشترك؟
BH+
2- احسب قيمة Kb للقاعدة B .
[OH-] = = = 0.5 x 10-5 = 5 x 10-6 M
Kb =
Kb = = 5 x 10-6
3- احسب النسبة  لتصبح pH = 8.3
لتصبح pH = 8.3
[H3O+] = 10-pH = 10-8.3 = 5 x 10-9 M
[OH-] = = = 0.2 x 10-5 = 2 x 10-6 M
Kb =
= = = 0.4
4- ما طبيعة تأثير محلول الملح BHNO3 ؟ (قاعدي، حمضي، متعادل)
حمضي.
الدورة الصيفية 2016
أ) يبيّن الجدول الآتي عدداً من محاليل الحموض الافتراضية متساوية التركيز (0.1 M) وقيم pH لها، ادرسه ثمّ أجب عن الأسئلة التي تليه:
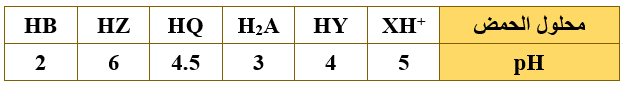
1- أي الحمضين أقوى HY أم HB ؟
HB
2- أي القاعدتين المرافقتين أقوى Q- أم HA- ؟
Q-
3- حدّد الأزواج المترافقة من الحمض والقاعدة عند تفاعل HY مع Q- .
(Q-/HQ) , (HY/Y-)
4- حدد الجهة التي يرجحها الاتزان عند تفاعل Z- مع HB .
يرجح الاتزان جهة النواتج.
5- اكتب صيغة القاعدة المرافقة للحمض XH+ .
X
6- أي الملحين لمحلوله أقل pH ( KY أم KZ ) عند تساوي التركيز؟
KY
7- احسب Ka للحمض HZ .
HZ + H2O Z- + H3O+
[H3O+] = 10-pH = 10-6 = 1 x 10-6 M
Ka = = = = 1 x 10-11
ب) احسب عدد غرامات NaOH اللازم إذابتها في (2 L) من الماء لتصبح pH للمحلول تساوي (12)،
علماً أن الكتلة المولية NaOH تساوي (40 g/mol)، Kw تساوي (1 x 10-14)
[H3O+] = 10-pH = 10-12 = 1 x 10-12 M
[OH-] = = = 1 x 10-2 M
NaOH Na+ + OH-
[OH-] = [NaOH] = 1 x 10-2 M
n = M x V = 1 x 10-2 x 2 = 2 x 10-2
m = n x Mr = 2 x 10-2 x 40 = 0.8 g
ج) حدّد قاعدة لويس في التفاعل الآتي:
Fe3+ + 6CN- [Fe(CN)6]3-
CN-
د) محلول يتكون من الحمض HX بتركيز (0.4 M) وملحه NaX بتركيز (0.4 M)،
إذا علمت أن Ka للحمض يساوي (1 x 10-5)، log = 0.2
أجب عما يلي:
1- احسب pH المحلول؟
HX + H2O X- + H3O+
Ka =
1 x 10-5 =
[H3O+] = 1 x 10-5 M
2- احسب pH المحلول بعد إضافة (0.1 mol) من الحمض HCl إلى لتر من المحلول السابق. (أهمل التغيّر في الحجم).
Ka =
1 x 10-5 =
[H3O+] = x 10-5 M
pH = -log [H3O+] = -log ( x 10-5) = 4.8
الدورة الشتوية 2017
أ) 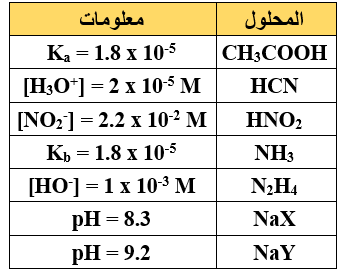 يبيّن الجدول المجاور محاليل مائية لحموض وقواعد وأملاح عند نفس التركيز (1 M) ومعلومات عنها.
يبيّن الجدول المجاور محاليل مائية لحموض وقواعد وأملاح عند نفس التركيز (1 M) ومعلومات عنها.
إذا علمت أن: = 1 x 10-14 Kw ، ادرس الجدول ثم أجب عن الأسئلة الآتية:
1- أي الحمضين هو الأقوى (HX أم HY)؟
HX
2- أي الحمضين هو الأضعف (CH3COOH أم HNO2)؟
CH3COOH
3- أيّ المحلولين يكون فيه [OH-] أعلى (HCN أم HNO2)؟
HCN
4- أي القاعدتين المرافقتين أقوى (CH3COO- أم CN-)؟
CN-
5- أي المحلولين له أقل (pH) (NH3 أم N2H4)؟
N2H4
6- حدد الجهة التي يرجحها الاتزان عند تفاعل X- مع HY.
يرجح الاتزان جهة المتفاعلات.
7- حدّد الأزواج المترافقة عند تفاعل NH4+ مع N2H4 .
(N2H4/N2H5+) , (NH4+/NH3)
8- ما طبيعة تأثير محلول الملح CH3COONa (حمضي، قاعدي، متعادل)؟
قاعدي.
ب) ادرس المعادلة الآتية ثم أجب عن الأسئلة التي تليها:
BF3 + NH3 F3B-NH3
1- أي المادتين المتفاعلتين تسلك كحمض وفق مفهوم لويس؟
BF3
2- ما نوع الرابطة المتكونة بين المادتين المتفاعلتين عند تكوين الناتج؟
تناسقية.
ج) محلول مُنظّم مكوّن من القاعدة الافتراضية B تركيزها (0.3 M) وملحها BHCl بالتركيز نفسه، فإذا علمت أن Kb = 1 x 10-6 ، log 2 = 0.3 ،= 1 x 10-14 Kw ، أجب عمّا يلي:
1- ما صيغة الأيون المشترك؟
BH+
2- احسب pH للمحلول بعد إضافة (0.05 mol) من الحمض HCl إلى (500 mL) من المحلول السابق. (أهمل التغير في الحجم).
أحسب تركيز الحمض HCl :
M = = = 0.1 M
Kb =
1 x 10-6 =
1 x 10-6 =
[OH-] = 5 x 10-7 M
[H3O+] = = = 2 x 10-8 M
pH = - log [H3O+] = - log (2 x 10-8) = 8 - log 2 = 8 - 0.3 = 7.7