 |
إجابات أسئلة مراجعة الوحدة
الذرة والجدول الدوري
السؤال الأول:
أكتب المفهوم المناسب لكل جملةٍ من الجمل الآتية:
- يُسمى أصغر جُسيم في المادة وغير القابل للتقسيم بالطرائق الفيزيائية والكيميائية البسيط: (الذرة)
- يُسمى الحيز الكثيف المتناهي في الصغر والذي يوجد في مركز الذرة: (النواة)
- يمثل عدد البروتونات الموجودة في داخل نواة أيّ ذرة: (العدد الذري)
- يُسمى المخطط الذي طور ونظمت العناصر فيه تنظيماً مرتباً ومتسلسلاً: (الجدول الدوري)
- يُطلق على المناطق الموجودة حول نواة الذرة والتي توجد فيها الإلكترونات: (مستويات الطاقة)
- يُسمى النموذج الذي يكون فيه رمز العنصر محاطاً بنقاط تمثل عدد إلكترونات التكافؤ الموجودة في مستوى الطاقة الخارجي فقط لذرة ذلك العنصر: (تركيب لويس النقطي)
السؤال الثاني:
أختار رمز الإجابة الصحيحة فيما يأتي:
1- تُسمى ذرات العنصر نفسه التي تحتوي نواها على أعداد نيوترونات مختلفة:
أ- البروتونات.
ب- النظائر.
ج- الإلكترونات.
د- الأيونات.
2- الجُسيمات التي يحدد عددها العدد الذري لأيّ عنصر هي:
أ- النيوترونات.
ب- البروتونات.
ج- الدورات.
د- مستويات الطاقة.
3- يمكن تحديد الدورة التي يقع فيها أيّ عنصر من خلال معرفة عدد:
أ- إلكترونات التكافؤ.
ب- مستويات الطاقة.
ج- النيوترونات.
د- العدد الكتلي.
4- يمثل العدد الكتلي لأيّ ذرةٍ عدد:
أ- البروتونات.
ب- النيوترونات.
ج- الإلكترونات.
د- البروتونات والنيوترونات.
5- الجُسيمات التي توجد داخل نواة ذرة أيّ عنصرٍ هي:
أ- البروتونات فقط.
ب- النيوترونات فقط.
ج- البروتونات والنيوترونات.
د- الإلكترونات فقط.
6- في الجدول الدوري الحديث، رُتبت العناصر فيه وفقاً لازدياد:
أ- كتلها الذرية.
ب- أعدادها الذرية.
ج- أعداد نيوتروناتها.
د- أعداد أيوناتها.
7- العناصر الصلبة، واللامعة، والقابلة للتشكيل، والموصلة للحرارة والكهرباء، والموجودة في الجانب الأيسر من الجدول الدوري هي:
أ- الفلزات.
ب- اللافلزات.
ج- أشباه الفلزات.
د- العناصر النبيلة.
8- يمكن تحديد المجموعة التي يقع فيها أيّ عنصر من خلال معرفة عدد:
أ- النيوترونات.
ب- إلكترونات التكافؤ.
ج- النظائر.
د- الأيونات.
9- تُسمى العناصر التي تمتلك مستويات طاقة خارجية مكتملة:
أ- الفلزات.
ب- اللافلزات.
ج- أشباه الفلزات.
د- الغازات النبيلة.
السؤال الثالث:
المهارات العلمية:
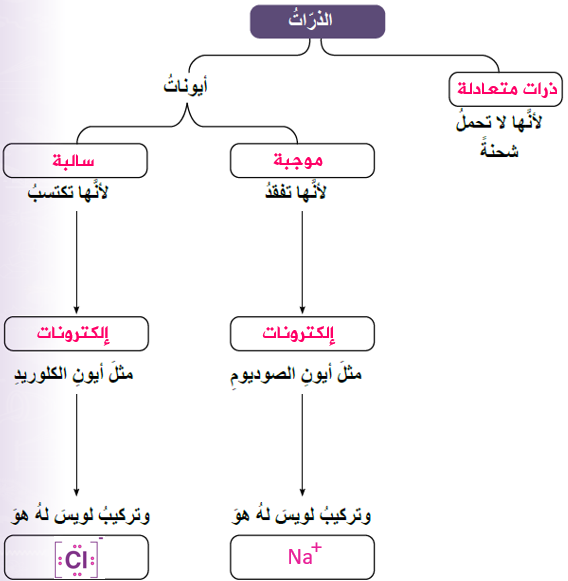
1- أكمل خريطة المفاهيم الآتية:
السؤال الرابع:
أصنف المواد الافتراضية (أ، ب، ج، د، هـ، و) الآتية إلى فلز أو لافلز أو شبه فلز، مستعيناً بالمعلومات الواردة في الجدول الآتي:
|
المادة |
المعلومة |
فلز/لافلز/شبه فلز |
|
أ |
لامعة، وصلبة، وقابلة للتشكيل على هيئة صفائح وأسلاك. |
فلز |
|
ب |
خصائصها متوسطة بين الفلزات واللافلزات. |
شبه فلز |
|
ج |
غازية، والصلبة منها هشة. |
لافلز |
|
د |
موصلة جيدة للحرارة والكهرباء. |
فلز |
|
هـ |
موصلة للحرارة والكهرباء بدرجة أقل من الفلزاتِ. |
شبه فلز |
|
و |
ضعيفة التوصيل للحرارة والكهرباء. |
لافلز |
السؤال الخامس:
أفسر لماذا اكتشفت النيوترونات بعد الإلكترونات والبروتونات.
لأنها جسيمات متعادلة الشحنة؛ لذا تأخر اكتشافها.
السؤال السادس:
أحسب عدد النيوترونات الموجودة في نواة ذرة متعادلة (لا تحمل أيّ شحنة) لأحد العناصر إذا كان عددها الكتلي يساوي 35 ، وعدد إلكتروناتها يساوي 17 .
عدد النيوترونات = العدد الكتلي – العدد الذري
عدد النيوترونات = 35 – 17 = 18 نيوترون.
السؤال السابع:
أتوقع أسباب ترتيب العلماء العناصر على هيئة مصفوفة منظمة ومرتبة سُميت الجدول الدوري.
رتبت العناصر في جدول دوري تسهيلاً لدراستها ولتصنيفها بناءً على التشابه في الخصائص الكيميائية والفيزيائية ولتزايد أعداد العناصر المكتشفة.
السؤال الثامن:
أكمل الجدول الآتي:
|
رمز العنصر |
عدده الذري |
التوزيع الإلكتروني |
عدد مستويات الطاقة |
الدورة التي يقع فيها |
عدد إلكترونات التكافؤ |
المجموعة التي يقع فيها |
|
A |
2 |
2 |
1 |
1 |
2 |
18 |
|
B |
7 |
2, 5 |
2 |
2 |
5 |
15 |
|
C |
10 |
2, 8 |
2 |
2 |
8 |
18 |
|
D |
13 |
2, 8, 3 |
3 |
3 |
3 |
13 |
السؤال التاسع:
أفسر سبب تسمية عناصر المجموعة الثامنة بالغازات النبيلة Noble Gases .
لأنها تمتلك مستويات طاقة مكتملة وممتلئة بالإلكترونات، ومن الصعب أن تفقد الإلكترونات أو تكتسبها.
السؤال العاشر:
أستنتج أي العناصر الافتراضية (3X , 10Y , 14Z) الآتية يعد عنصراً مستقراً، ولماذا؟
يعد العنصر الافتراضي Y هـو العنصر المستقر؛ لأن مستوى طاقته الخارجي مكتمل وممتلئ بالإلكترونات، ولا يمكن أن يفقد الإلكترونات أو يكتسبها.
السؤال الحادي عشر:
أستنتج لماذا تميل الذرات إلى تكوين الأيونات.
تميل الذرات إلى تكوين الأيونات للوصول على حالة الاستقرار، بحيث تمتلك توزيعًا إلكترونيًا مشابهًا للتوزيع الإلكتروني للغاز النبيل، ويحدث هذا الاستقرار للذرات إما عندما تفقد الإلكترونات من مستوى طاقتها الخارجي أو تكتسبها.
السؤال الثاني عشر:
أتوقع تركيب لويس النقطي للذرة المتعادلة للعنصر الافتراضي (17W)، وتركيب لويس للأيون الذي سوف يتكون منها.
أكتب التوزيع الإلكتروني للعنصر الافتراضي W، لتحديد عدد إلكترونات تكافؤه:
W: 2, 8, 7
عدد إلكترونات تكافؤه تساوي 7، ويمكن تمثيل ذرة هذا العنصر والأيون الذي سيتكون منها باستخدام تركيب لويس النقطي على النحو الآتي:
