 |
إجابات الأسئلة الإضافية
السؤال الأول:
ضع دائرة حول رمز الإجابة الصحيحة في الفقرات الآتية:
- قوى ثنائية القطب تربط بين:
ب- الجزيئات القطبية.
- المركب الذي تترابط جزيئاته بأعلى قوى تجاذب هو:
ب- C4H10
- المركب الذي تتماسك جزيئاته بقوى لندن فقط هو:
ج- CCl4
- إحدى المواد التالية ترتبط جزيئاتها بشكل رئيس بقوى لندن وهي:
د- CO2
- ترتيب الجزيئات ( HCl , H2O , CH4 , HF ) حسب تناقص قوى الترابط بين جزيئاتها في الحالة السائلة هو:
د- CH4 < HCl < HBr < H2O
- المادة التي تترابط وحداتها البنائية الأساسية في الحالة السائلة بقوى لندن فقط هي:
ب- Ar
- أحد المواد الآتية ترتبط ذراتها بقوى لندن وهي:
ج- Ne
- المادة (في الحالة السائلة) التي ترتبط جزيئاتها بأضعف قوى ترابط هي:
ج- CH3CH2CH2CH3
السؤال الثاني:
|
مواد ترتبط دقائقها بقوى لندن فقط |
مواد ترتبط دقائقها بقوى تجاذب هيدروجيني |
مواد ترتبط دقائقها بقوى تجاذب ثنائيات القطب |
|
CH4 |
HF |
HCl |
|
Kr |
CH3CH2NH2 |
H2S |
|
Br2 |
CH3CH2CH2CH2OH |
OF2 |
|
N2 |
|
CH3F |
|
CH3CH2CH3 |
|
ICl |
|
SiCl4 |
|
NO |
|
O2 |
|
HBr |
السؤال الثالث:
المركب HOCH2CH2OH يمتلك درجة غليان أعلى من CH3CH2CH2OH لأنه يكوّن ترابطاً هيدروجينياً من طرفين (عدد الترابط الهيدروجيني أكبر).
السؤال الرابع:
درجة غليان المركب CH3CH2CH2CH2NH2 أعلى من درجة غليان المركب CH3CH2CH2NH2 فكلاهما تترابط جزيئاته بروابط هيدروجينية إلا أن الكتلة المولية للمركب الأول أعلى من الثاني.
السؤال الخامس:

السؤال السادس:
نوع قوى التجاذب الرئيسة:
|
ترابط هيدروجيني |
قوى ثنائية القطب |
قوى لندن |
|
C2H5OH C3H7NH2 |
NO H2S |
C8H18 Ar O2 I2 |
السؤال السابع:
فسر:
أ- الرابطة B-F قطبية، والجزيء BF3 غير قطبي:
الرابطة B-F قطبية لأن الفرق في الكهرسلبية بين الذرتين لا يساوي صفر، أما الجزيء BF3 فهو غير قطبي لأن محصلة قوى قطبية الروابط تساوي صفر.
ب- درجة غليان المركب HOCH2CH2OH أعلى من درجة غليان المركب CH3CH2CH2OH بالرغم من تقارب كتلتيهما المولية:
كلا الجزيئين يترابطان بروابط هيدروجينية، إلا أن عدد الروابط الهيدروجينية التي يكونها المركب الأول أكبر من الثاني لوجود مجموعتي هيدروكسيل فيه.
ج- الروابط بين جزيئات CH3F ليست روابط هيدروجينية:
لعدم وجود ارتباط مباشر بين ذرة الهيدروجين وذرة الفلور.
السؤال الثامن:
ترتيب الجزيئات تبعاً لزيادة درجة غليانها:
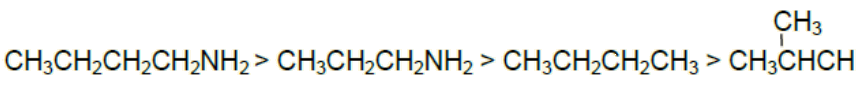
السؤال التاسع:
سؤال الشكل:
أ- تزداد درجة الغليان بزيادة الكتلة المولية.
ب- فسّر:
- ارتفاع درجة غليان الماء مقارنة بمركبات عناصر المجموعة السادسة:
لوجود ترابط هيدروجيني قوي بين جزيئات الماء، بينما تترابط مركبات عناصر المجموعة السادسة بقوى ثنائية القطب الأضعف من الترابط الهيدروجيني.
- ارتفاع درجة غليان المركب HF مقارنة بمركبات عناصر المجموعة السابعة:
- لوجود ترابط هيدروجيني قوي بين جزيئات HF ، بينما تترابط مركبات عناصر المجموعة السابعة بقوى ثنائية القطب الأضعف من الترابط الهيدروجيني.
- نقصان درجة غليان المركب CH4 مقارنة بعناصر المجموعة الرابعة:
تترابط عناصر المجموعة الرابعة بقوى لندن الضعيفة، وأضعف قوى لندن تكون بين جزيئات CH4 لأن كتلته المولية منخفضة.