 |
تمثيل لويس للأيونات عديدة الذرات
مثال (1):
أكتب تركيب لويس في الأيون AlCl4- . (العدد الذري لذرة Al = 13 ، وللذرة Cl = 17).
الحل:
أولاً: أحدد عدد إلكترونات التكافؤ لذرات الأيون:
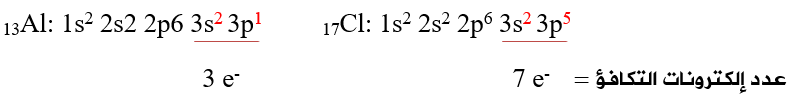
ثانياً: أحسب عدد إلكترونات التكافؤ الكلي لجميع ذرات الأيون، ونضيف (e) لوجود شحنة (1-):
عدد إلكترونات التكافؤ الكلي = (عدد إلكترونات تكافؤ Al × عدد ذراته) + (عدد إلكترونات تكافؤ Cl × عدد ذراته) + 1
Total (v.e) = (3 x 1) + (7 x 4) + 1 = 32e-
ثانياً: أحسب عدد أزواج إلكترونات التكافؤ (v.e.p):
v.e.p = = 16
ثانياً: أوزع ذرات Cl حول الذرة المركزية Al ، وأرسم رابطة أحادية بين ذرة الألمنيوم وذرات الكلور.
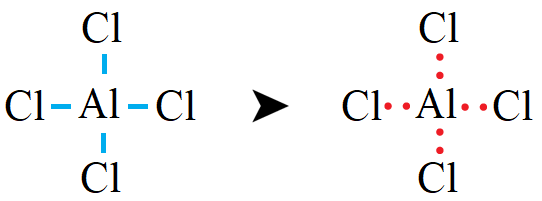
ثالثاً: أحسب عدد أزواج الإلكترونات المتبقية (l.e.p) وتساوي:
n(l.e.p) = n(v.e.p) – n(b.e.p) = 16 – 4 = 12
رابعاً: أوزع الأزواج المتبقية على ذرات الكلور بحيث أحقق قاعدة الثمانية:
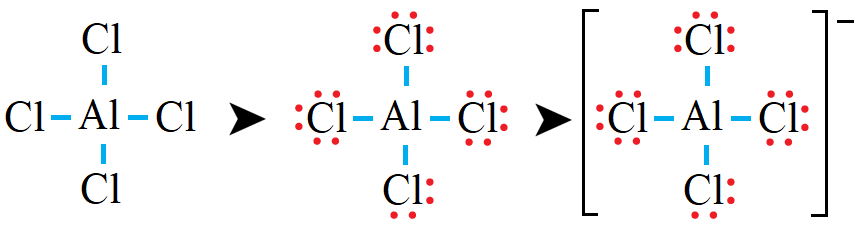
لاحظ أن ذرات الكلور حققت قاعدة الثمانية، وكذلك الحال لذرة الألمنيوم.
مثال (2):
أكتب تركيب لويس في أيون الأمونيوم NH4+ . (العدد الذري لذرة N = 7 ، وللذرة H = 1).
الحل:
أولاً: أحدد عدد إلكترونات التكافؤ لذرات الأيون:
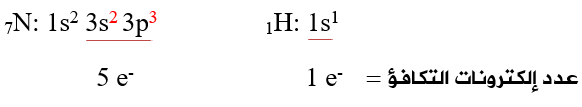
ثانياً: أحسب عدد إلكترونات التكافؤ الكلي لجميع ذرات الأيون، وأطرح (e) لوجود شحنة (1+):
عدد إلكترونات التكافؤ الكلي = (عدد إلكترونات تكافؤ N × عدد ذراته) + (عدد إلكترونات تكافؤ H × عدد ذراته) - 1
Total (v.e) = (5 x 1) + (1 x 4) - 1 = 8e-
ثالثاً: أحسب عدد أزواج إلكترونات التكافؤ (v.e.p):
v.e.p = = 4
رابعاً: أوزع ذرات H حول الذرة المركزية N ، ونرسم رابطة أحادية بين ذرة النيتروجين وذرات الهيدروجين.
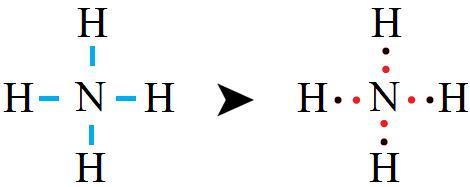
خامساً: أحسب عدد أزواج الإلكترونات المتبقية (l.e.p) وتساوي:
n(l.e.p) = n(v.e.p) – n(b.e.p) = 4 – 4 = 0
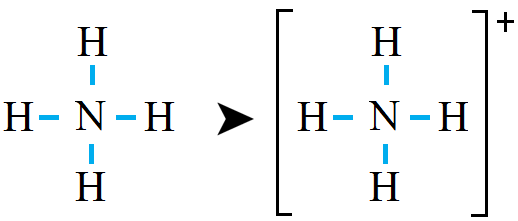
لاحظ أن ذرة النيتروجين حققت قاعدة الثمانية.