 |
أسئلة المحتوى وإجاباتها
الصيغ الكيميائية وخصائص المركبات
الشكل 11 صفحة (70):
نموذج بلورة المركب الأيوني
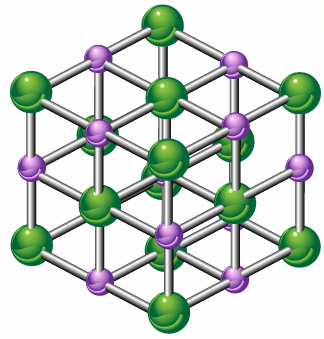
أفسر النسبة بين أيونات الصوديوم إلى أيونات الكلوريد في البلورة.
النسبة (1:1).
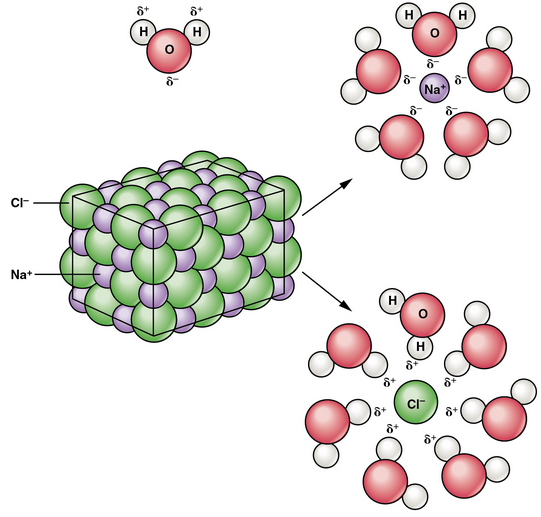 الشكل 12 صفحة (71):
الشكل 12 صفحة (71):
• أفسر أثر الشحنات على جزيء الماء في ذوبان المركب الأيوني.
تتجاذب الأطراف الموجبة من جزيء الماء مع الأيونات السالبة في بلورة المركب الأيوني، وكذلك تتجاذب الأطراف السالبة له مع الأيونات الموجبة في البلورة؛ مما يؤدي إلى فصل الأيونات من البلورة، بحيث تصبح حرة الحركة في الماء.
• ما الفرق بين الذوبان والانصهار؟
الذوبان: انتشار جسيمات المذاب؛ سواء جزيئات أو أيونات بانتظام بين جزيئات المذيب.
الانصهار: تحول المادة من الحالة الصلبة إلى الحالة السائلة.
التجربة 1 صفحة (72):
التوصيل الكهربائي للمركبات الأيونية
التحليل والاستنتاج:
أفسر إضاءة المصباح في حالة المحلول.
عند ذوبان المركب الأيوني في الماء، تتحرر الأيونات التي كانت مقيدة الحركة، وتصبح قادرة على الحركة بحرية؛ ما يجعلها قادرة على التوصيل الكهربائي للتيار.
أتحقق صفحة (72):
أفسر ارتفاع درجة انصهار المركبات الأيونية.
بسبب قوة الرابطة الأيونية الناتجة عن التجاذب القوي بين الأيونات المختلفة في الشحنة.
التجربة 2 صفحة (73):
التوصيل الكهربائي للمركبات التساهمية
التحليل والاستنتاج:
أفسر عدم توصيل سكر الجلوكوز للتيار الكهربائي في الحالتين: الصلبة، والمحلول.
لأن سكر الجلوكوز يتكون من جزيئات متعادلة ولا يتأين في الماء.
أتحقق صفحة (74):
أذكر الخصائص العامة للمركبات التساهمية.
درجة انصهارها وغليانها منخفضة نسبياً، ولا تذوب غالباً في الماء، وغير موصلة للتيار الكهربائي.
أتحقق صفحة (75):
أفسر ما يأتي: الفلزات قابلة للطرق والسحب.
صفوف الأيونات الموجبة ينزلق بعضها عن بعض، ولكنها تظل في بحر الإلكترونات نفسه.
أتحقق صفحة (79):
أكتب الصيغة الكيميائية للمركبات الآتية:
• كبريتات الصوديوم.
Na2SO4
• فوسفات الكالسيوم.
Ca2(PO4)2
• نتريد المغنيسيوم.
Na3N
أتحقق صفحة (80):
إذا كان فرق السالبية الكهربائية بين الذرتين المكونتين للرابطة C-N يساوي 0.6 فما نوع هذه الرابطة؟
تساهمية.