 |
العلاقة بين عدد المولات وسرعة استهلاك المتفاعلات وإنتاج النواتج
انظر إلى التفاعل التالي:
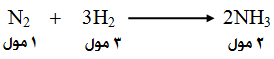
تعني المعادلة أنّ:
إنتاج (2) مول من NH3 يتطلب استهلاك (1) مول من N2 ، واستهلاك (3) مول من H2 .
فلو أردنا مثلاً أن نجد العلاقة بين معدل سرعة استهلاك N2 ومعدل سرعة إنتاج NH3 نقول:
معدل سرعة إنتاج NH3 = ضعف معدل سرعة استهلاك N2
أو
معدل سرعة إنتاج NH3 = 2 × معدل سرعة استهلاك N2
أو
معدل سرعة إنتاج NH3 = معدل سرعة استهلاك N2
أو
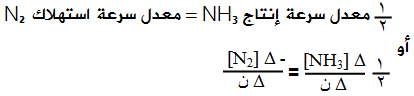
وهذا يعني أنه لإيجاد العلاقة بين معدل سرعة استهلاك أو إنتاج مادة مع معدل سرعة استهلاك أو إنتاج مادة أخرى نضرب معدل الاستهلاك أو الإنتاج في مقلوب المعامل من المعادلة الكيميائية الموزونة.
سؤال 1 :
من خلال المعادلة الكيميائية السابقة اكتب العلاقة بين سرعة استهلاك H2 ومعدل سرعة تكوّن NH3 .
سؤال 2 :
جد العلاقة بين معدل سرعة استهلاك O2 ، ومعدل سرعة إنتاج N2O5 في المعادلة الموزونة التالية بدلالة التغير في التركيز في وحدة الزمن:
2N2 + 5O2 → 2N2O5
سؤال 3 :
في التفاعل الآتي:C2H4 + 3O2 → 2CO2 + 2H2O ، إذا كان معدل سرعة اختفاء O2 = 0,45 مول/لتر.ث، فاحسب معدل ظهور CO2 .
سؤال 4 :
يتفاعل الهيدروجين مع اليود لتكوين يوديد الهيدروجين HI وفق المعادلة التالية:
H2 + I2 → 2HI
ولدى دراسة تغير تركيز H2 مع الزمن أمكن الحصول على البيانات التالية:
|
الزمن (الثانية) |
[H2] |
|
صفر |
0,018 |
|
2 |
0,016 |
|
8 |
0,010 |
احسب معدل سرعة:
- استهلاك H2 في الفترة الزمنية من (2 - 8) ثانية.
- إنتاج HI خلال الفترة الزمنية نفسها.
- استهلاك I2 في الفترة الزمنية من (صفر - 2) ثانية.
سؤال 5 :
في التفاعل الغازي 2A → B + 3C ، وجد أن تركيز A خلال (10) ثانية قد تغير من (1,6) مول/لتر إلى (0,4) مول/لتر . احسب معدل سرعة:
- تكوّن B خلال الفترة الزمنية ذاتها.
- إنتاج C خلال الفترة الزمنية ذاتها.
سؤال 6 :
يتفكك المركب الافتراضي A2B3 بالحرارة وفقاً للمعادلة الآتية: A2B3 → 2A + 3B
أجب عن الأسئلة الآتية:
- إذا تغير تركيز A2B3 من (0,8) مول/لتر إلى (0,2) مول/لتر خلال (3) دقائق.
احسب معدل سرعة استهلاك A2B3 بوحدة مول/لتر.دقيقة
- إذا كان معدل سرعة إنتاج A يساوي (0,4) مول/لتر.دقيقة، فما معدل سرعة إنتاج B خلال الفترة الزمنية نفسها؟
سؤال 7 :
يتفاعل غاز الأمونيا والأكسجين حسب المعادلة التالية:
4NH3 + 3O2 → 2N2 + 6H2O
فإذا كان معدل سرعة إنتاج غاز النتروجين عند زمن معين يساوي 1,2 مول/لتر . ثانية ، فما معدل سرعة:
- إنتاج بخار الماء H2O ؟
- استهلاك غاز الأكسجينO2 ؟
- اختفاء غاز الأمونيا NH3 ؟
سؤال 8 :
في التفاعل التالي:
2N2O5 → 4NO2 + O2
إذا كان معدل سرعة إنتاج O2 = 0,40 مول/لتر . ث ، فما معدل سرعة:
- استهلاك N2O5 ؟
- تكوّن NO2؟
سؤال 9 :
إذا تغير تركيز NO2 في التفاعل:
N2O4 → 2NO2
من 0,24 مول/لتر إلى 0,48 مول/لتر خلال دقيقتين، فما معدل سرعة:
- إنتاج NO2 بوحدة مول/لتر . دقيقة؟
- تكوّن NO2 بوحدة مول/لتر . ثانية؟
- استهلاك N2O4 في الفترة الزمنية ذاتها بوحدة (مول/لتر.دقيقة)؟
سؤال 10 :
ادرس التفاعل الآتي ثم أجب عن السؤال الذي يليه:
A + 2B → 3Z
بعد مرور (10) ث من بداية التفاعل تغيّر [B] من 0,8 مول/لتر إلى 0,6 مول/لتر، احسب [Z] بعد مرور (10) ث من بداية التفاعل.
سؤال 11 :
يتفاعل A و B حسب المعادلة التالية: aA + bB → C ( a و b عدد مولات المتفاعلات )
فإذا وضع (1) مول من المادة A مع (2) مول من المادة B في وعاء حجمه (2) لتر، وبعد مرور (10) دقائق تبين أن في الوعاء (0,5) مول من المادة A و (0,5) مول من المادة B .
- احسب معدل سرعة استهلاك A .
- احسب معدل سرعة استهلاك B .
- ما قيمة كلّ من a و b في المعادلة الكيميائية؟
سؤال 12 : أسئلة موضوعية وزارية
- في التفاعل الآتي : 2NO2 + F2 → 2NO2F ، إذا كان معدل سرعة إنتاج NO2F = 0,10 مول/لتر. ث فإن معدل سرعة استهلاك F2 (مول/لتر . ث) يساوي:
أ) (0,03) ب) (0,05) ج) (0,10) د) (0,20)
- في التفاعل الآتي: 2NO2 + F2 → 2NO2F إذا كان معدل سرعة استهلاك F2 = 0,2 مول/لتر . ث ، فإن معدل سرعة إنتاج NO2F (مول/لتر . ث) يساوي:
أ) 0,1 ب) 0,2 ج) 0,4 د) 0,6
- في التفاعل الآتي: طاقة +C3H8 + 5O2 → 3CO2 + 4H2O ، إذا كان معدل سرعة استهلاك (O2) = 0,010 مول/لتر . ث ، فإن معدل سرعة تكوّن H2O ( بالمول/لتر . ث ) يساوي:
أ) 1,25 × 10-3 ب) 8 × 10-3 ج) 1,25 × 10-2 د) 8 × 10-2
- في التفاعل الآتي: CH4 + 2O2 → CO2 + 2H2O ، إذا كان معدل سرعة استهلاك CH4 = (0,12) مول/لتر . ث ، فإن معدل سرعة تكوّن H2O ( المول/لتر . ث ) يساوي:
أ) 0,06 ب) 0,12 ج) 0,14 د) 0,24
- في التفاعل الآتي: C2H4 + 3O2 → 2CO2 + 2H2O ، إذا كان معدل سرعة اختفاء O2 = 0,45 مول/لتر . ث ، فإن معدل ظهور CO2 يساوي:
أ) 0,15 ب) 0,30 ج) 0,45 د) 0,60
- في التفاعل+ 2Cl- ClO3- → 3ClO- سرعة إنتاج ClO3- (0,06) مول/لتر.ث فتكون سرعة استهلاك ClO- تساوي (مول/لتر.ث):
أ) 0,02 ب) 0,06 ج) 0,12 د) 0,18
- لديك التفاعل الافتراضي الآتي: 2A2 + B2 → 2A2B ، إذا كان معدل سرعة استهلاك B2 (0,04) مول/لتر . ث، فإن معدل سرعة إنتاج A2B تساوي:
أ) 0,02 ب) 0,04 ج) 0,08 د) 0,16
- في التفاعل: B + 3C → 2E ، تكون سرعة استهلاك C تساوي:
أ) ثلث سرعة استهلاك B ب) ثلاثة أضعاف سرعة استهلاك B
ج) ضعف سرعة إنتاج E د) ثلثي سرعة إنتاج E
- في التفاعل الآتي: 2N2O5 → 4NO2 + O2 ، نجد أن معدل:
أ) سرعة تكوّن NO2 = نصف سرعة استهلاك N2O5
ب) سرعة تكوّن NO2 = سرعة استهلاك N2O5
ج) سرعة تكوّن O2 = ضعف سرعة استهلاك N2O5
د) سرعة تكوّن O2 = نصف سرعة استهلاك N2O5