 |
أولاً: طريقة التفاعلات النصفية
Half – Reactions Method
موازنة التفاعلات في الوسط الحمضي
الخطوة الأولى:
نفصل المعادلة الكلية إلى نصفين يدل أحدهما على التأكسد والآخرعلى الاختزال.
الخطوة الثانية:
نوازن ذرات العناصر ما عدا الأكسجين والهيدروجين.
الخطوة الثالثة:
نوازن ذرات الأكسجين بإضافة عدد من جزيئات الماء إلى الطرف الذي ينقصه الأكسجين.
الخطوة الرابعة:
نوازن ذرات الهيدروجين بإضافة عدد من أيونات (H+) إلى الطرف الذي ينقصه الهيدروجين.
الخطوة الخامسة:
نوازن الشحنات الكهربائية بإضافة عددٍ من الإلكترونات لأحد طرفي المعادلة بحيث تتساوى الشحنات الكهربائية في طرفيها.
الخطوة السادسة:
نضرب إحدى المعادلتين النصفيتين أو كلتيهما بأبسط أرقام صحيحة لمساواة عدد الإلكترونات المفقودة بعدد الإلكترونات المكتسبة.
الخطوة السابعة:
نجمع نصفي التفاعل جمعاً جبرياً وذلك بحذف الإلكترونات والمكونات الأخرى المتماثلة من الطرفين.
الخطوة الثامنة:
نتحقق من صحة الموازنة بموازنة الذرات والشحنات.
مثال:
وازن المعادلة التالية بطريقة التفاعلات النصفية، والتي تتم في وسط حمضي:
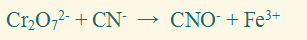
الحل:
الخطوة الأولى:
نفصل المعادلة الكلية إلى نصفين يدل أحدهما على التأكسد والآخرعلى الاختزال.
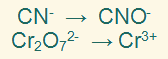
الخطوة الثانية:
نوازن ذرات العناصر ما عدا الأكسجين والهيدروجين.
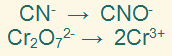
الخطوة الثالثة:
نوازن ذرات الأكسجين بإضافة عدد من جزيئات الماء إلى الطرف الذي ينقصه الأكسجين.
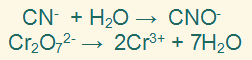
الخطوة الرابعة:
نوازن ذرات الهيدروجين بإضافة عدد من أيونات (H+) إلى الطرف الذي ينقصه الهيدروجين.
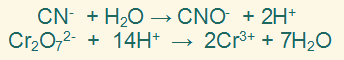
الخطوة الخامسة:
نوازن الشحنات الكهربائية بإضافة عددٍ من الإلكترونات لأحد طرفي المعادلة بحيث تتساوى الشحنات الكهربائية في طرفيها.
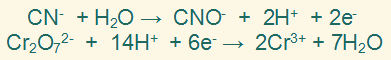
الخطوة السادسة:
نضرب المعادلة النصفية الأولى في (3)، والمعادلة النصفية الثانية في (1) وذلك لمساواة عدد الإلكترونات في النصفين.
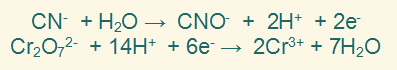
فتصبح المعادلتين على النحو التالي:
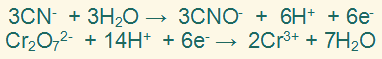
الخطوة السابعة:
نجمع نصفي التفاعل جمعاً جبرياً وذلك بحذف الإلكترونات والمكونات الأخرى المتماثلة من الطرفين.
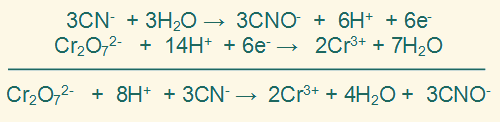
الخطوة الثامنة:
تحقق من صحة الموازنة بموازنة الذرات والشحنات.
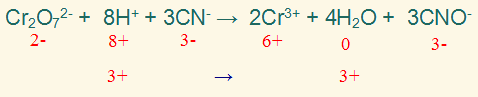
سؤال (1):
وازن المعادلة الأيونية الآتية بطريقة التفاعلات النصفية (وسط حمضي):
MnO4- + C2O42- → Mn2+ + CO2
سؤال (2):
يتم التفاعل الآتي في وسط حمضي، أجب على الأسئلة التي تليه:
HSO3- + IO3- → SO42- + I2
1- وازن المعادلة بطريقة التفاعلات النصفية.
2- حدد العامل المؤكسد.
3- ما عدد تأكسد اليود في الأيون (IO3-).
سؤال (3):
يتم التفاعل الآتي في وسط حمضي:
MnO4- + CH3CH2OH → Mn2+ + CH3COOH
وازن المعادلة بطريقة التفاعلات النصفية، ثم حدد العامل المؤكسد والعامل المختزل في التفاعل.