 |
نظرية بور
Bohr’s Theory
نموذج رذرفور
وضع رذرفورد نموذجاً للذرة افترض فيه أن الذرة تتكون من نواة موجبة الشحنة، تتركز فيها معظم كتلة الذرة، وتدور حولها الإلكترونات في مسارات دائرية؛ ما يجعل الذرة متعادلة كهربائياً.
أسهمت قوانين الفيزياء في دحض هذا النموذج؛ فقد أفادت بوجوب فقد الإلكترون الطاقة باستمرار في أثناء دورانه حول النواة، ما يعني أنه يدور في مسار يقل نصف قطره تدريجياً إلى أن يسقط الإلكترون في النواة، وتتهدم الذرة، وهذا ما لا يحدث فعلياً.
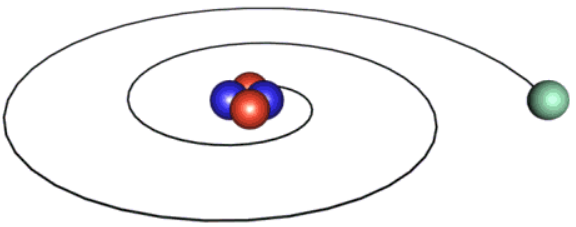
نظرية بور
توصل بور إلى نظرية تفسر حركة الإلكترونات حول النواة في ذرة الهيدروجين من دون سقوطها في المركز. وتضمنت نظريته افتراضين، هما:
(1) تحتوي الذرات على مستويات طاقة رئيسة يرمز لها بالرمز (n)، وتستخدم فيها الأعداد (1, 2, 3, 4, …) وتكون طاقة الإلكترون مساوية لطاقة المستوى الموجود فيه.
وتحسب طاقة المستوى الموجود فيه الإلكترون من العلاقة:

(2) تتغير طاقة الإلكترون في الذرة على النحو الآتي:
- يكتسب الإلكترون طاقة محددة تسمح له بالانتقال من المستوى الموجود فيه إلى مستوى طاقة أعلى.
- يشع الإلكترون طاقة محددة (كم) تسمى فوتونات عند انتقاله من مستوى طاقة أعلى إلى مستوى طاقة أقل؛ فينشأ طيف الانبعاث الخطي.
كيف تمكن بور من تفسير الطيف الخطي لذرة الهيدروجين؟
يكون الإلكترون في حالة الاستقرار في مستوى الطاقة الأدنى (n=1)، وتصبح الذرة مثارة عندما يكتسب الإلكترون طاقة محددة تمكنه من الانتقال إلى مستوى طاقة أعلى، وعند عودة الإلكترون من جديد إلى حالة الاستقرار يفقد مقادير محددة من الطاقة (فوتونات) على شكل إشعاعات ضوئية، لها أطوال موجية تظهر على شكل خطوط في طيف العنصر.
وتظهر بعض هذه الخطوط في منطقة الطيف المرئي والبعض الآخر في منطقة الطيف غير المرئي، والخطوط التي تظهر في المنطقة المرئية هي الناتجة عن عودة الإلكترون من مستوى علوي إلى المستوى الثاني.
