خلايا التحليل الكهربائي
المواد الكهرلية والمواد اللاكهرلية
تصنف المواد حسب قدرة محاليلها على إيصال التيار الكهربائي إلى قسمين، هما:
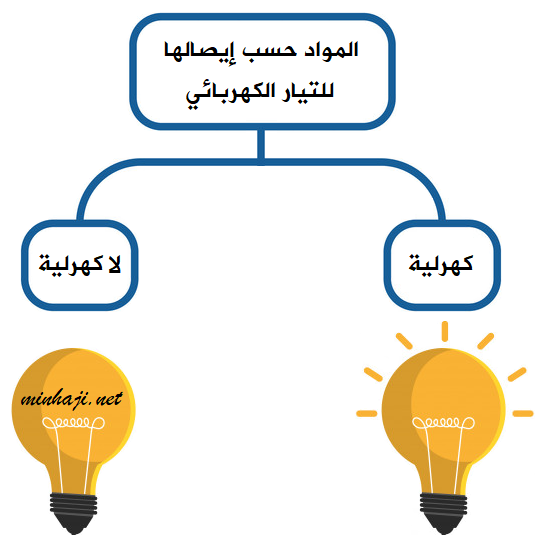
المواد الكهرلية
وهي المواد التي يوصل محلولها المائي أو مصهورها التيار الكهربائي.
مثال:
المركبات الأيونية، وهي مواد تتكون من أيونات مقيدة الحركة في حالة الصلابة، وتصبح حرة الحركة عند صهرها أو إذابتها في الماء، كملح الطعام (كلوريد الصوديوم).
المواد اللاكهرلية
وهي المواد التي لا يوصل محلولها المائي أو مصهورها التيار الكهربائي.
مثال:
المركبات الجزيئية، وهي مواد تتكوّن من جزيئات متعادلة، وتبقى متعادلة عند صهرها أو إذابتها في الماء، كالسكر.
توصيل محاليل ومصاهير المواد الكهرلية للتيار
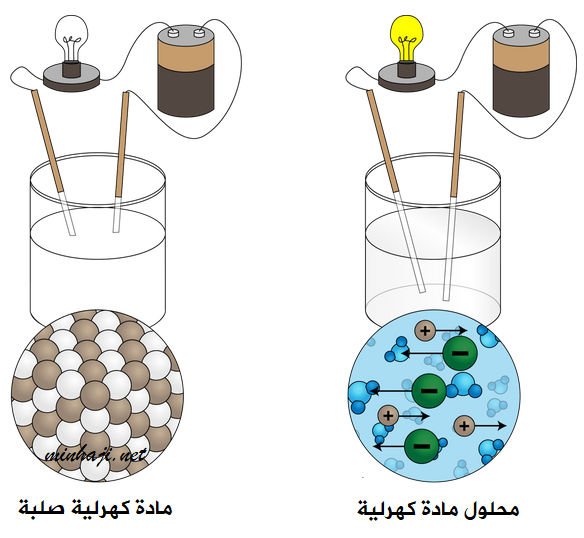
يؤدي صهر المواد الكهرلية أو إذابتها في الماء إلى تحرر أيوناتها؛ وتصبح سهلة الحركة فتوصل التيار الكهربائي.
أما في حالة المواد الكهرلية الصلبة، فإن أيوناتها تكون مقيدة، فلا توصل التيار الكهربائي.
خلايا التحليل الكهربائي
خلية التحليل الكهربائي: جهاز يحتوي على محلول أو مصهور كهرلي وقطبين، يحدث فيه تفاعل كيميائي (غير تلقائي) نتيجة مرور تيار كهربائي فيه يؤدي إلى تحويل الطاقة الكهربائية إلى طاقة كيميائية.
صفات خلية التحليل الكهربائي
- يحدث فيها تفاعل تأكسد واختزال غير تلقائي.
- تحتاج التفاعلات التي تتم فيها إلى طاقة كهربائية.
- تحولات الطاقة فيها من طاقة كهربائية إلى طاقة كيميائية.
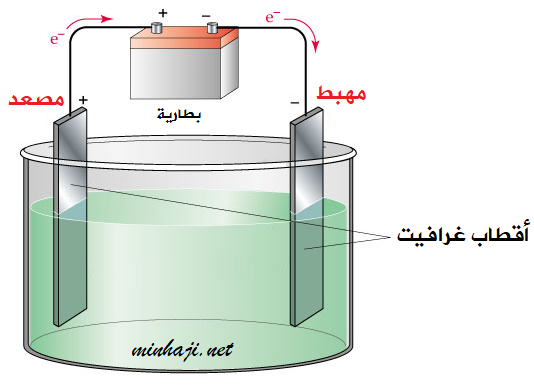
أجزاء خلية التحليل الكهربائي
- مصعد (+): وهو عبارة عن قطب غرافيت، وتحدث عنده عملية التأكسد للأيونات السالبة.
- مهبط (-): وهو عبارة عن قطب غرافيت، وتحدث عنده عملية الاختزال للأيونات الموجبة.
- محلول أو مصهور مادة كهرلية.
- مصدر تيار (بطارية).
خطوات التحليل الكهربائي
- تعمل الحرارة (في حالة المصهور) والماء (في حالة المحلول) على تفكيك المادة الكهرلية إلى أيونات موجبة وأخرى سالبة.
- يتجه كل أيون إلى القطب المعاكس له في الشحنة.
- يحدث اختزال للأيون الموجب عند المهبط.
- يحدث تأكسد للأيون السالب عند المصعد.
مثال:
التحليل الكهربائي لمحلول كلوريد النحاس CuCl2
خطوات التحليل:
يعمل الماء على تفكيك كلوريد النحاس إلى أيونات نحاس موجبة، وأيونات كلوريد سالبة.
CuCl2 → Cu2+ + 2Cl-
تتجه أيونات النحاس الموجبة نحو المهبط (-) وتتعرض للاختزال بفعل الكهرباء القادمة من البطارية، وتتحول إلى ذرات نحاس.
Cu2+ + 2e- → Cu
تتجه أيونات الكلوريد السالبة نحو المصعد (+) وتتأكسد بفقد إلكترونات تعود إلى البطارية، وتتحول أيونات الكلوريد إلى غاز الكلور.
2Cl- → Cl2 + 2e-
سؤال (1):
عند إجراء تحليل كهربائي لمحلول بروميد المغنيسيوم MgBr2 أجب عمّا يلي:
- اكتب معادلة تفكك بروميد المغنيسيوم في الماء.
- أين تتجه الأيونات الناتجة في المحلول؟
- اكتب معادلة التفاعل الذي يحدث عند كل قطب.
- ما العناصر التي تنتج عن هذه العملية؟
الحل:
- معادلة تفكك بروميد المغنيسيوم في الماء:
MgBr2 → Mg2+ + 2Br-
- تتجه أيونات المغنيسيوم نحو القطب السالب (المهبط)، وتتجه أيونات البروميد نحو القطب الموجب (المصعد).
- معادلة التفاعل الذي يحدث عند كل قطب:
Mg2+ + 2e- → Mg
2Br- → Br2 + 2e-
- العناصر التي تنتج عن هذه العملية: يتكون عنصر المغنيسيوم عند المهبط، والبروم عند المصعد.
سؤال (2):
اكتب معادلات كيميائية تمثل التفاعلات التي تحدث على الأقطاب عند مرور تيار كهربائي في مصهور كلّ من:
- بروميد الصوديوم NaBr .
- كلوريد الكالسيوم CaCl2 .
الحل:
يتفكك بروميد الصوديوم بالحرارة وفق المعادلة:
NaBr → Na+ + Br-
معادلة المهبط:
Na+ + e- → Na
معادلة المصعد:
2Br- → Br2 + 2e-
يتفكك كلوريد الكالسيوم بالحرارة وفق المعادلة:
CaCl2 → Ca2+ + 2Cl-
معادلة المهبط:
Ca2+ + 2e- → Ca
معادلة المصعد:
2Cl- → Cl2 + 2e-
إعداد : شبكة منهاجي التعليمية
25 / 04 / 2020
النقاشات