حساب تركيز الهيدرونيوم في محاليل الحموض القوية
في حالة الحموض القوية يكون التأين تاماً تقريباً، ويمكن اعتبار [H3O+] مساوياً لتركيز الحمض قبل التأين.
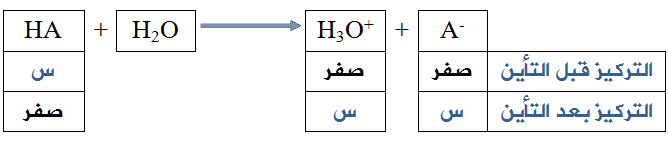
أي أن:
[H3O+] بعد التأين = [HA] قبل التأين
سؤال (1):
إذا كان لديك محلول لحمض النتريك HNO3 تركيزه (0,002) مول/لتر:
احسب قيمة (pH) لذلك المحلول. (لــو 2 = 0,3)
الحل:
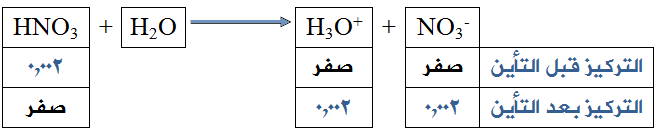
[H3O+] بعد التأين = [HNO3] قبل التأين = 2 × 10-3 مول/لتر
pH = - لــو [H3O+]
= - لــو ( 2 × 10-3)
= - لــو 2 – لـو 10-3
= - لــو 2 + 3 لـو 10
= -0,3 + ( 3 × 1)
= 2,7
سؤال (2):
احسب الرقم الهيدروجيني (pH) لكلا المحلولين الآتيين:
- حمض البيركلوريك HClO4 الذي تركيزه 1,5 × 10-2 مول/لتر.
- حمض HBr الذي تركيزه 3 × 10-2 مول/لتر.
علماً بأن لـو 1,5 = 0,18 ، لـو 3 = 0,5
بيّن أي المحلولين أكثر حمضية.
ملاحظة:
أحياناً لا يُعطى التركيز مباشرةً في السؤال، يمكنك استخدام العلاقتين التاليتين لحسابه:
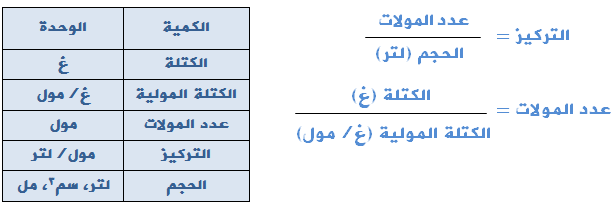
ولتحويل الحجم من مل أو سم3 إلى لتر إقسم على 1000
وإجمالاً تنحصر الحسابات في المخطط التالي:
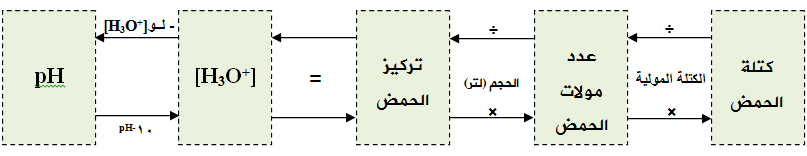
سؤال (3):
أذيب (0,2) مول من حمض HCl في (400) مل ماء. احسب قيمة (pH) لهذا المحلول. (لـو 5 = 0,7).
سؤال (4):
أذيب 1,27 غ من الحمض HA في 100 مل من الماء، فكانت قيمة الرقم الهيدروجيني pH للمحلول الناتج 2، هل تتوقع ان يكون الحمض HA قوياً أم ضعيفاً؟ وضح إجابتك. (الكتلة المولية للحمض HA = 127 غ/مول)
إعداد : أ. أحمد الحسين
08 / 08 / 2020
النقاشات