تطور الجدول الدوري
The Periodic Table
لتسهيل دراسة العناصر، لجأ العلماء لترتيب العناصر في جدول يُسمى الجدول الدوري.
الجدول الدوري: تنظيم للعناصر، يسهّل دراستها والتنبؤ بخصائصها وسلوكها، وهو مرتب في صفوفٍ أفقيةٍ وأعمدة.
جدول مندليف
رتب العالم الروسي مندليف العناصر المعروفة آنذاك في جدول، وفق لتزايد كتلها الذرية، ووضع العناصر المتشابهة في خصائصها تحت بعض، وقد ترك مندليف فراغات لعناصر لم تكن مكتشفة في ذلك الوقت.
جدول موزلي
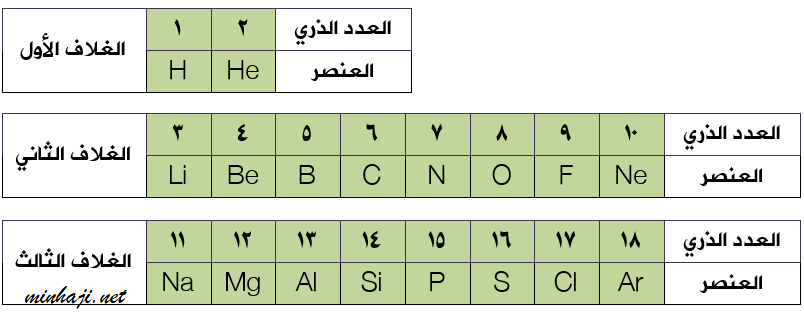
رتب العالم موزلي العناصر في جدول وفقاً لتزايد أعدادها الذرية بدلاً من كتلها الذرية، وكلما مرة يبدأ بغلاف جديد كان يبدأ خطاً أفقياً.
ضم جدوله في السطر الأول عنصرين (سعة الغلاف الأول إلكترونين).
في السطر الثاني ضم ثمانية عناصر (سعة الغلاف الثاني 8 إلكترونات).
وهكذا رتب العناصر المعروفة آنذاك في خطوطٍ أفقية أطلق عليها اسم دورات، وخطوطٍ عمودية أطلق عليها اسم مجموعات.
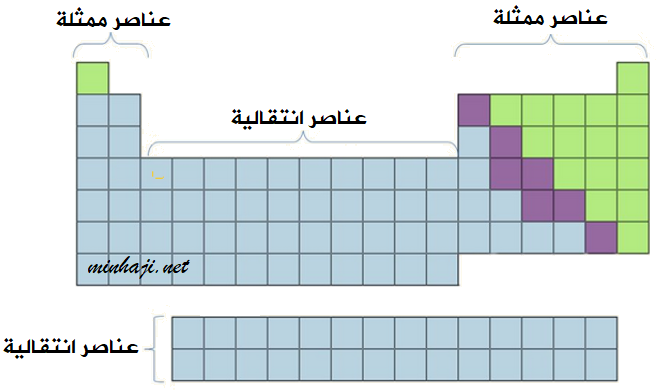
العناصر الممثلة والعناصر الانتقالية
تنتمي العناصر في الجدول الدوري إلى نوعين المجموعات، هما:
1- العناصر الممثلة:
وهما العمودان على يسار الجدول الدوري وستة أعمدة على يساره.
2- العناصر الانتقالية:
وهي العناصر التي تقع في وسط الجدول الدوري، والسطران الأفقيان أسفل الجدول الدوري.
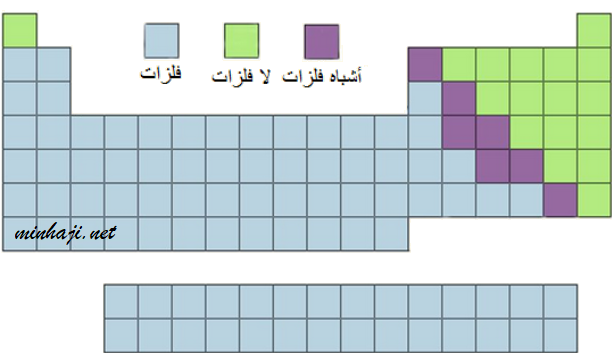
الفلزات واللافلزات وأشباه الفلزات
جميع العناصر الانتقالية فلزات، بينما العناصر الممثلة بعضها فلزات، وبعضها لا فلزات، والبعض الآخر أشباه فلزات.
خصائص الفلزات
- جميعها صلبة ما عدا الزئبق.
- درجات انصهارها مرتفعة.
- لامعة.
- موصلة جيدة للحرارة والكهرباء.
- قابلة للطرق صفائح، وللسحب أسلاك.
خصائص اللافلزات
- قد تكون سائلة أو غازية أو صلبة هشة عند درجة حرارة الغرفة.
- رديئة التوصيل الحراري والكهربائي.
- غير قابلة للطرق والسحب.
أشباه اللافلزات
عناصر تشترك في بعض خصائها وصفاتها مع الفلزات، وفي بعضها الآخر مع اللافلزات.
إعداد : شبكة منهاجي التعليمية
29 / 08 / 2022
النقاشات