إجابات مراجعة الدرس الثاني
قوانين سرعة التفاعل
السؤال الأول:
الفكرة الرئيسة: أوضّح كيفية التوصل إلى رتبة تفاعل مادة متفاعلة من الرسم البياني.
أرسم بيانياً العلاقة بين التركيز مقابل زمن التفاعل، وبما أن ميل المنحنى عند أي نقطة زمن يساوي سرعة التفاعل عند تلك النقطة؛ فإنه يمكن حساب سرعات مختلفة للتفاعل عند تراكيز معينة، وبعد ذلك يُرسم رسم بياني آخر يبين سرعة التفاعل مقابل تركيز المادة المتفاعلة ويتيح لنا نمط هذا الرسم تحديد رتبة التفاعل بالنسبة لمادة معينة.
السؤال الثاني:
أوضح المقصود بالرتبة الكلية للتفاعل.
الرتبة الكلية للتفاعل: مجموع رتب المواد المتفاعلة في قانون سرعة التفاعل.
السؤال الثالث:
في التفاعل الافتراضي بين A و B عند درجة حرارة ثابتة؛ كانت بيانات التفاعل كما يأتي:
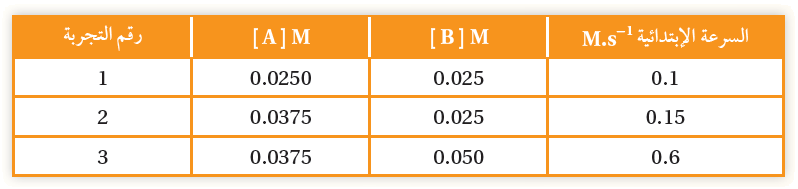
أ- أستنتج رتبة التفاعل للمادة المتفاعلة A
الرتبة الأولى.
ب- أستنتج رتبة التفاعل للمادة المتفاعلة B
الرتبة الثانية.
ج- أستنتج قانون السرعة لهذا التفاعل.
R = k [A]1 [B]2
د- أحسب قيمة ثابت سرعة التفاعل، وأحدد وحدته؟
R = k [A]1 [B]2
0.1 = k [0.0250]1 [0.025]2
k = 6.4 x 10-3 M-2.s
هـ- أحسب سرعة التفاعل عندما تركيز A يساوي تركيز B يساوي 0.01 M
R = k [A]1 [B]2
R = 6.4 x 10-3 [0.1]1 [0.1]2
R = 6.4 x 10-3 M/s
السؤال الرابع:
في التفاعل الافتراضي نواتج → T + E + D
سجلت بيانات خمس تجارب عند درجة حرارة ثابتة كما يأتي:
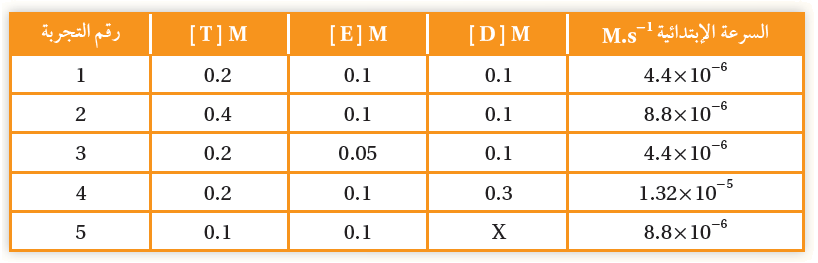
أ- أستنتج رتبة التفاعل للمادة المتفاعلة T
الرتبة الأولى.
ب- أستنتج رتبة التفاعل للمادة المتفاعلة E
الرتبة صفرية.
ج- أستنتج رتبة التفاعل للمادة المتفاعلة D
الرتبة الأولى.
د- أستنتج قانون سرعة هذا التفاعل.
R = k [T]1 [D]1
هـ- أحسب تركيز المادة D في التجربة الأخيرة.
بتطبيق قانون السرعة على أي تجربة (مثلاً التجربة الأولى) وإيجاد قيمة ثابت السرعة (k)، ثم تعويضه في قانون السرعة وتعويض معطيات التجربة رقم (5).
طريقة أخرى: نقسم معطيات التجربة رقم (5) على أي تجربة أخرى (مثلاً الثانية):
=
وباختصار قيمة ثابت السرعة k ؛ لأنه ثابت تصبح العلاقة:
=
1 =
1 =
X = 0.4 M
إعداد : شبكة منهاجي التعليمية
22 / 06 / 2023
النقاشات