المولالية (التركيز المولالي)
Molality
تحسب مولارية محلول بقسمة عدد مولات المذاب على حجم المحلول، إلا أن مولارية المحلول تعتمد على درجة الحرارة؛ إذ إنّ زيادة درجة حرارة المحلول تقلل من تركيزه، وبما أن كتل المواد لا تتأثر بتغير درجة الحرارة، فقد ابتكر الكيميائيون طريقة لحساب تركيز المحلول بدلالة كتلة المذيب، وهو التركيز المولالي أو المولالية.
المولالية: نسبة عدد مولات المذاب في 1K من المذيب.
ويعبر عن المولارية بالعلاقة الرياضية:
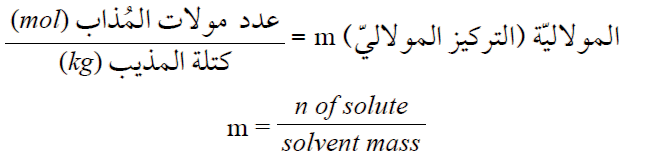
وتقاس المولالية بوحدة (mol/Kg) أو (molal) وتلفظ مولال.
مثال (1):
أحسب مولالية محلول تكون بإذابة 6 mol من سكر الجلوكوز في 8 Kg من الماء المقطر.
تحليل السؤال (المعطيات)
عدد مولات المذاب (الجلوكوز) = 6 mol
كتلة المذيب (الماء) = 8 Kg
الحل:
m =
m = = 0.75 m
أتحقق صفحة (80):
أحسب مولالية المحلول الذي يحتوي على 8.4 g فلوريد الصوديوم NaF مذابة في 400 g من الماء المقطر. علماً أن الكتلة المولية (NaF) Mr = 42 g/mol
تحليل السؤال (المعطيات)
كتلة المذاب (فلوريد الصوديوم) = 8.4 g
كتلة المذيب (الماء) = 400 g
الحل:
أحسب أولاً عدد مولات المذاب (n):
n = = = 0.2 mol
أحسب مولالية المحلول:
m =
m = = 0.5 m
إعداد : أ. أحمد الحسين
02 / 11 / 2024
النقاشات