الروابط الهيدروجينية
Hydrogen Bonding
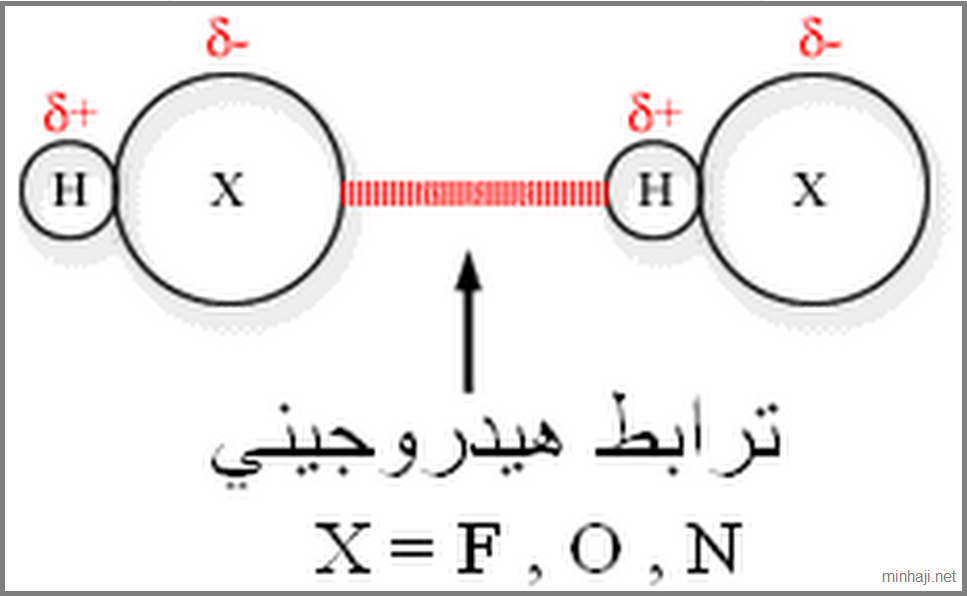
الترابط الهيدروجيني: قوى تجاذب قوية نسبياً تربط الجزيئات القطبية التي تحتوي على ذرة هيدروجين مرتبطة برابطة تساهمية مع إحدى الذرات صغيرة الحجم وذات كهرسلبية عالية مثل الفلور والأكسجين والنتروجين.
الرابطة التساهمية أقصر من الترابط الهيدروجيني، لذا فالرابطة التساهمية أقوى من الترابط الهيدروجيني.
شروط حدوث الترابط الهيدروجيني:
- أن يكون الجزيئان قطبيان، فالترابط الهيدروجيني حالة خاصة من قوى ثنائية القطب.
- أن ترتبط ذرة H مع إحدى الذرات (N, O, F) في الجزيء نفسه برابطة تساهمية.
مثال (1):
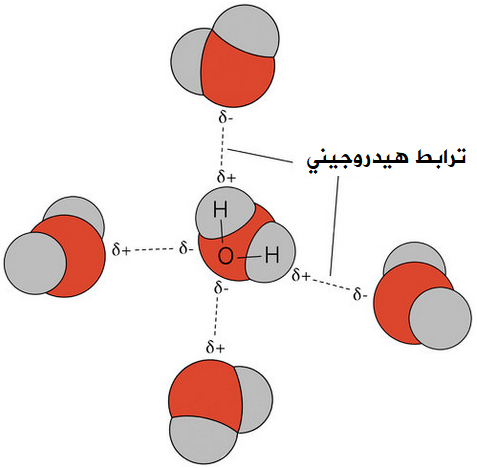
جزيء الماء H2O
الماء H2O قطبي، ويحتوي على رابطة تساهمية من نوع H-O ، لذا فإن جزيئات الماء تترابط فيما بينها بروابط هيدروجينية.
مثال (2):
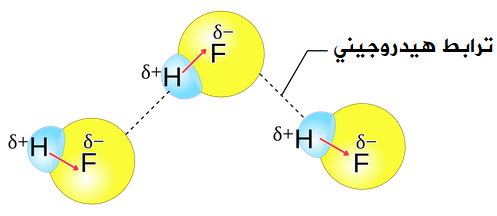
جزيء فلوريد الهيدروجين HF
جزيء HF قطبي، ويحتوي على رابطة تساهمية من نوع H-F ، لذا فإن جزيئاته تترابط فيما بينها بروابط هيدروجينية.
مثال (3):
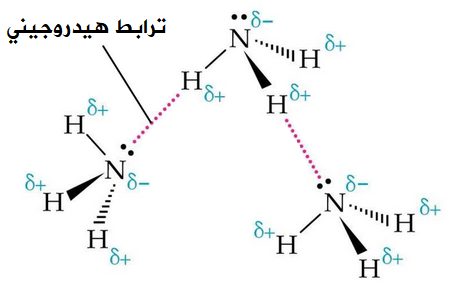
جزيء الأمونيا NH3
جزيء NH3 قطبي، ويحتوي على رابطة تساهمية من نوع H-N ، لذا فإن جزيئاته تترابط فيما بينها بروابط هيدروجينية.
أثر الترابط الهيدروجيني على خصائص الجزيئات
إن وجود قوى الترابط الهيدروجيني بين الجزيئات القطبية يرفع من درجة الغليان.
مثال:
الجدول التالي يبين الحالة الفيزيائية لكل من الماء وكبريتيد الهيدروجين في درجة حرارة الغرفة، ودرجتي غليانهما:
|
الجزيء |
الحالة الفيزيائية |
درجة الغليان هس |
|
H2O |
سائل |
100 |
|
H2S |
غاز |
- 61 |
ولكن ما سبب اختلاف المركبين في الحالة الفيزيائية، والتباين الكبير في درجتي غليانهما على الرغم من وقوع الأكسجين والكبريت في مجموعة واحدة في الجدول الدوري، أي أن لهما الشكل الفراغي نفسه؟
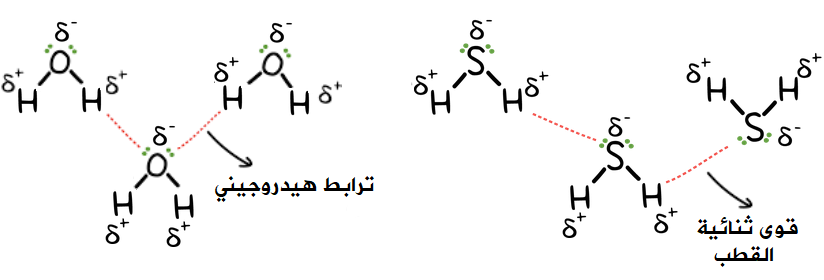
تترابط جزيئات الماء بروابط هيدروجينية ترفع من درجة غليانه، بينما تترابط جزيئات كبريتيد الهيدروجين بقوى ثنائية القطب، وهي أضعف من الترابط الهيدروجيني الموجود بين جزيئات الماء.
العوامل المؤثرة على الترابط الهيدروجيني
1- عدد الروابط الهيدروجينية.
بزيادة عدد الروابط الهيدروجينية، تزداد قوى التجاذب بين الجزيئات، وتزداد معها درجة غليان الجزيء.
مثال:
درجة غليان غليكول إيثيلين HOCH2CH2OH أعلى من درجة غليان الإيثانول CH3CH2OH ، لأن عدد الروابط الهيدروجينية التي يكونها غلايكول إيثيلين أكثر من عدد الروابط الهيدروجينية التي يكونها الإيثانول.
2- الكتلة المولية.
إذا تساوى مركبان في عدد الروابط الهيدروجينية، فإن المركب الذي يمتلك كتلة مولية أكبر تكون قوى لندن بين جزيئاته أكبر، فتزداد قوى التجاذب وتزداد معها درجة الغليان.
مثال:
درجة غليان 1-بروبانول CH3CH2CH2OH أعلى من درجة غليان الإيثانول CH3CH2OH ، لأن الكتلة المولية للمركب 1-بروبانول أكبر من الكتلة المولية للإيثانول، فتزداد قوى لندن وتزداد معها درجة الغليان.
إعداد : أ. أحمد الحسين
15 / 10 / 2021
النقاشات
Raoo al-maerh
شرح بيجننن
إضافة رد
0 ردود