المردود المئوي
Percentage Yield
يحرص الكيميائيون في المصانع على حساب المردود المئوي للتفاعل، والذي يُمثل بالعلاقة:

الناتج النظري: أكبر كتلة يمكن الحصول عليها من استهلاك كتلة معلومة من إحدى المواد المتفاعلة.
الناتج الفعلي: الكتلة التي نحصل عليها عمليًا في المختبر أو الصناعة.
وفي الغالب يكون الناتج الفعلي أقل من الناتج النظري؛ أي أن المردود المئوي أقل من 100% ، ويعود ذلك لعدّة عوامل، منها:
- عدم اكتمال التفاعل.
- استعمال مواد متفاعلة غير نقية.
- فقدان جزء من الناتج عن طريق الترشيح أو نقله إلى وعاء آخر.
- الخطأ في القياس.
لذا يحرص الكيميائيون على حساب المردود المئوي وذلك لتحسين ظروف التفاعل، للوصول إلى ناتج فعلي قريب من الناتج النظري، أي أن يكون المردود المئوي قريب من 100%.
مثال:
سخن 120 غ من ثاني أكسيد السليكون SiO2 مع كمية كافية من الكربون C حسب المعادلة:
SiO2 + 3C → SiC + 2CO
فإذا نتج عملياً في المختبر 50 غ من كربيد السليكون SiC ، فاحسب المردود المئوي للتفاعل. (الكتلة المولية لـ SiO2 = 60 غ/مول، ولـ SiC = 40 غ/مول).
الحل:
كتلة الناتج الفعلي = 50 غ.
نحسب الناتج النظري كالتالي:
المادة المعطاة هي أكسيد السليكون SiO2 ، والمادة المطلوبة SiC .
نحسب عدد مولات أكسيد السليكون:

ومن المعادلة الكيميائية الموزونة نربط علاقة بين عدد مولات أكسيد السليكون وكربيد الكالسيوم:
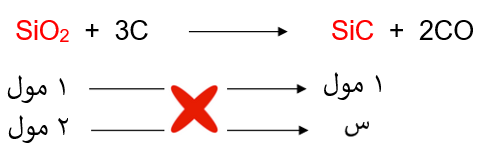
إذاً: عدد مولات كربيد الكالسيوم = 2 مول.
نحسب كتلة كربيد الكالسيوم من عدد مولاته، وهي تمثل كتلة الناتج النظري:
كتلة كربيد الكالسيوم = عدد مولاته × الكتلة المولية
= 2 × 40 = 80 غ
والآن نحسب المردود المئوي للتفاعل:

سؤال:
يُحضر الميثانول CH3OH في الصناعة حسب المعادلة الآتية:
CO + 2H2 → CH3OH
فإذا تفاعل 100 غ من H2 مع كمية كافية من CO ، ونتج 700 غ من الميثانول CH3OH في المصنع، فاحسب المردود المئوي للتفاعل (الكتلة المولية لـ C = 12 ، H = 1 ، و O = 16 غ/مول).
الحل:
كتلة الناتج الفعلي = 700 غ.
نحسب الناتج النظري كالتالي:
المادة المعطاة هي الهيدروجين H2 ، والمادة المطلوبة CH3OH .
نحسب عدد مولات الهيدروجين:

ومن المعادلة الكيميائية الموزونة نربط علاقة بين عدد مولات الهيدروجين والميثانول:
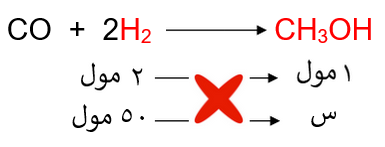
إذاً: عدد مولات الميثانول = 25 مول.
نحسب كتلة الميثانول من عدد مولاته، وهي تمثل كتلة الناتج النظري:
كتلة الميثانول = عدد مولاته × الكتلة المولية
= 25 × 32 = 800 غ
والآن نحسب المردود المئوي للتفاعل:

إعداد : شبكة منهاجي التعليمية
05 / 02 / 2021
النقاشات