إجابات أسئلة مراجعة الوحدة الثالثة
المركبات والروابط الكيميائية
السؤال الأول:
أضع دائرة حول رمز الإجابة الصحيحة لكل جملةٍ ممّا يأتي:
1- نوع الرابطة في مركب كلوريد الليثيوم:
أ- رابطة تساهمية أحادية.
ب- رابطة تساهمية ثنائية.
ج- رابطة أيونية.
د- رابطة فلزية.
2- نوع الرابطة بين ذرات عنصر الصوديوم Na:
أ- رابطة تساهمية أحادية.
ب- رابطة تساهمية ثنائية.
ج- رابطة أيونية.
د- رابطة فلزية.
3- واحدة من الصيغ الكيميائية الآتية تحتوي على رابطة أيونية:
أ- CO.
ب- H2O .
ج- MgO .
د- HCl.
4- واحدة من الصيغ الكيميائية الآتية تحتوي على رابطة تساهمية ثلاثية:
أ- N2.
ب- O2 .
ج- H2 .
د- Cl2 .
5- الصيغة الكيميائية لمركب نترات الكالسيوم هي:
أ- CaNO3 .
ب- Ca(NO3)2 .
ج- Ca2NO3 .
د- Ca2(NO3)2 .
6- عدد روابط سيجما وروابط باي في الصيغة:
CH3CH=CH2 هو:
أ- 3 سيجما، 2 باي.
ب- 5 سيجما، 2 باي.
ج- 8 سيجما، 1 باي.
د- 9 سيجما، 1 باي.
7- عند اتحاد ذرات العنصر X الذي عدده الذري (7) مع ذرات عنصر Y الذي عدده الذري (17)، فإن صيغة الجزيء الناتج هي:
أ- XY7
ب- X3Y
ج- XY3
د- X7Y
8- إحدى الآتية ليست من خصائص المركبات الأيونية:
أ- ذائبيتها في الماء عالية.
ب- موصلة للكهرباء في حالة المحلول.
ج- درجة غليانها مرتفعة.
د- متطايرة.
9- المادة الموصلة للتيار الكهربائي في الحالة الصلبة هي:
أ- Mg
ب- NaCl
ج- CH4
د- He
10- إذا كان فرق السالبية الكهربائية بين ذرتين أكبر من 2 وفقاً لمقياس باولنج، فإن الرابطة المتوقعة هي:
أ- فلزية.
ب- أيونية.
ج- تساهمية أحادية.
د- تساهمية ثلاثية.
11- إذا كان التمثيل النقطي لعنصر هو ( )، فإن العدد الذري للعنصر هو:
)، فإن العدد الذري للعنصر هو:
أ- 3.
ب- 5.
ج- 13.
د- 15.
السؤال الثاني:
أوضّح المقصود بالمصطلحات الآتية:
الرابطة الأيونية، الرابطة التساهمية، الرابطة الفلزية، التكافؤ، تركيب لويس.
الرابطة الأيونية: القوة التي تجذب الأيونات ذات الشحنات المُختلفة في المركبات.
الرابطة التساهمية: الرابطة الكيميائية الناتجة من مشاركة ذرتين أو أكثر من العناصر اللافلزية لزوج أو أكثر من الإلكترونات.
الرابطة الفلزية: سحابة إلكترونية تحيط بنوى ذرات العناصر الفلزية لتوصلها إلى حالة استقرارٍ شبيهة بذرات عناصر الغازات النبيلة.
تركيب لويس: التمثيل النقطي لإلكترونات التكافؤ وفيه يُرمز إلى كلّ إلكترون تكافؤ بنقطةٍ واحدةٍ توضع على رمز العنصر.
السؤال الثالث:
أقارن بين المركبات الأيونية والمركبات التساهمية من حيث الخصائص المذكورة في الجدول الآتي:
|
الخاصية |
المركبات الأيونية |
المركبات التساهمية |
|
درجات الانصهار والغليان |
عالية |
منخفضة غالباً |
|
الذائبية في الماء |
تذوب |
لا تذوب غالباً |
|
توصيل الكهرباء في الحالة الصلبة |
غير موصلة |
غير موصلة ما عدا الغرافيت |
|
توصيل الكهرباء في حالة المحلول |
موصلة |
غير موصلة بشكل عام |
السؤال الرابع:
أدرس المعادلة الكيميائية الموزونة الآتية جيداً:
2Ca + O2 → 2CaO ، ثمّ:
أ- أمثل المواد المتفاعلة في تركيب لويس.
ب- أمثل المواد الناتجة في تركيب لويس.

ج- أوضح كيف وصلت ذرة الكالسيوم Ca إلى توزيع إلكتروني يشبه التوزيع الإلكتروني للغاز النبيل.
ذرة الكالسيوم تفقد إلكترونين من المستوى الخارجي، فتتحول إلى أيون الكالسيوم الثنائي الموجب الأقرب إلى الغاز النبيل الآرغون.
د- أجد تكافؤ كل من ذرتي الكالسيوم والأكسجين.
تكافؤ ذرة الكالسيوم هو 2، وتكافؤ ذرة الأكسجين هو 2.
السؤال الخامس:
أكتب الصيغة الكيميائية للمركبات الآتية:
نترات الأمونيوم، هيدروكسيد الحديد (II)، كبريتات الكالسيوم.
- نترات الأمونيوم: NH4NO3
- هيدروكسيد الحديد (II): Fe(OH)2
- كبريتات الكالسيوم: CaSO4
السؤال السادس:
أصمم تجربة أميز فيها بين مركب بروميد البوتاسيوم KBr وشمع البرافين.
التوصيل الكهربائي لمصهور كل منهما.
السؤال السابع:
أفسّر ما يأتي:
أ- الفلزات موصلة جيدة للتيار الكهربائي.
لوجود إلكترونات حرة الحركة في بلورة الفلز.
ب- درجة انصهار مركب أكسيد المغنيسيوم MgO أعلى من درجة انصهار مركب كلوريد الصوديوم NaCl .
درجة الانصهار ودرجة الغليان لمركب MgO الذي يحمل الشحنتين Mg2+O2+ أعلى من درجتي انصهار Na+Cl- وغليانه؛ لأن زيادة الشحنات على الأيونات تؤدي إلى زيادة قوة التجاذب بينها، فتحتاج إلى طاقة أكبر للتغلب عليها.
السؤال الثامن:
أفسر سبب عدم قابلية المركبات الأيونية للطرق والسحب، مستعيناً بنموذج الرابطة الفلزية.
في الرابطة الأيونية؛ تكون الأيونات المختلفة في الشحنة متقاربة ومترابطة، يمكن أن ينتج عن طرقها وانزلاق صفوف الأيونات أن تصبح الأيونات المتشابهة في الشحنة متقاربة، مما يؤدي إلى تنافرها؛ لذلك تكون غير قابلة للطرق.
السؤال التاسع:
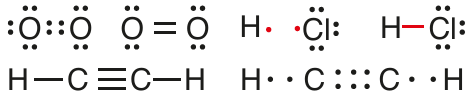
أستنتج كيف تتكون الرابطة التساهمية الأحادية والثنائية والثلاثية في المركبات الآتية:
O2 ، C2H2 ، HCl مستخدماً تركيب لويس.
السؤال العاشر:
أفسر البيانات: أدرس جيداً الشكل الآتي الذي يمثل جزيء الميثانول CH3OH، ثم أجيب عن الأسئلة التي تليه:
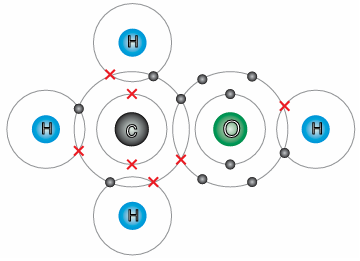
أ- أبين عدد إلكترونات التكافؤ لكل من ذرتي C و O .
عدد إلكترونات تكافؤ ذرة الكربون هو 4، وعدد إلكترونات تكافؤ ذرة الأكسجين هو 6
ب- أحدد نوع الروابط التساهمية المتكونة في هذا الجزيء.
روابط تساهمية أحادية.
ج- أذكر عدد أزواج الإلكترونات الرابطة.
عدد أزواج إلكترونات الرابطة هو 5
د- أمثل الجزيء باستخدام تركيب لويس.
نستخدم إلكترونات التكافؤ لكل ذرة لكتابة رمز لويس للجزيء.
السؤال الحادي عشر:
أتوقع تكافؤ كل من: ClO3 و Al في المركب الآتي: Al(ClO3)3 .
ClO3: 1
Al: 3
السؤال الثاني عشر:
أكتب الصيغة الكيميائية لمركب يكون فيه تكافؤ النحاس 2، ومركب آخر يكون فيه تكافؤ النحاس 1.
CuCl, CuCl2
السؤال الثالث عشر:
أستنتج: العناصر الافتراضية الآتية متتالية كما يأتي:
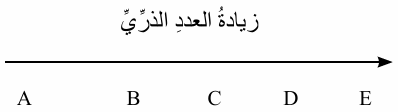
إذا كان العنصر B في مركباته أيوناً أحادياً سالباً، فما نوع الرابطة التي تنشأ بين ذرات العناصر الآتية:
أ- A مع B .
تساهمية.
ب- B مع D .
أيونية.
ج- B بعضها مع بعض.
تساهمية.
د- E بعضها مع بعض.
فلزية.
السؤال الرابع عشر:
أستنتج: أي المواد الآتية:
(Al, CH4, KCI, C2H2, C2H4) تعد مثالاً على مادة:
أ- توصل التيار الكهربائي وهي في الحالة الصلبة؟ Al
ب- توصل التيار الكهربائي وهي في حالة المحلول؟ KCI
ج- قابلة للطرق والسحب؟ Al
د- روابطها تساهمية أحادية؟ CH4
هـ- تمتلك رابطة تساهمية ثنائية؟ C2H4
و- تمتلك رابطة تساهمية ثلاثية؟ C2H2
السؤال الخامس عشر:
أصمم خريطة مفاهيمية: درست في الوحدة الثانية المفاهيم الأساسية الآتية، أصمم خريطة مفاهيمية مناسبة لتحديد العلاقات بين هذه المفاهيم:

السؤال السادس عشر:
أتفحص الأيونات في الكأس الزجاجية، ثم أستنتج أكبر عدد من المركبات التي قد تتكون من هذه الأيونات في حال تبخر الماء.
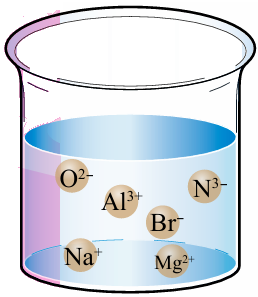
AlN, AlBr3, Al2O3, Na2O, NaBr, Na3N, MgO, Mg3N2, MgBr2
إعداد : شبكة منهاجي التعليمية
22 / 12 / 2024
النقاشات