الرابطة التساهمية
Covalent Bond
مفهوم الرابطة التساهمية
الرابطة التساهمية: رابطة كيميائية تنشأ بين ذرتين من خلال التشارك في الإلكترونات.
تنشأ الرابطة التساهمية بين ذرتين (لافلزين) تميلان لكسب الإلكترونات، فتتشارك الذرتان بالإلكترونات، ليصبح عدد الإلكترونات في مستوى الطاقة الخارجي لهما مكتمل بالإلكترونات.
مثال (1):
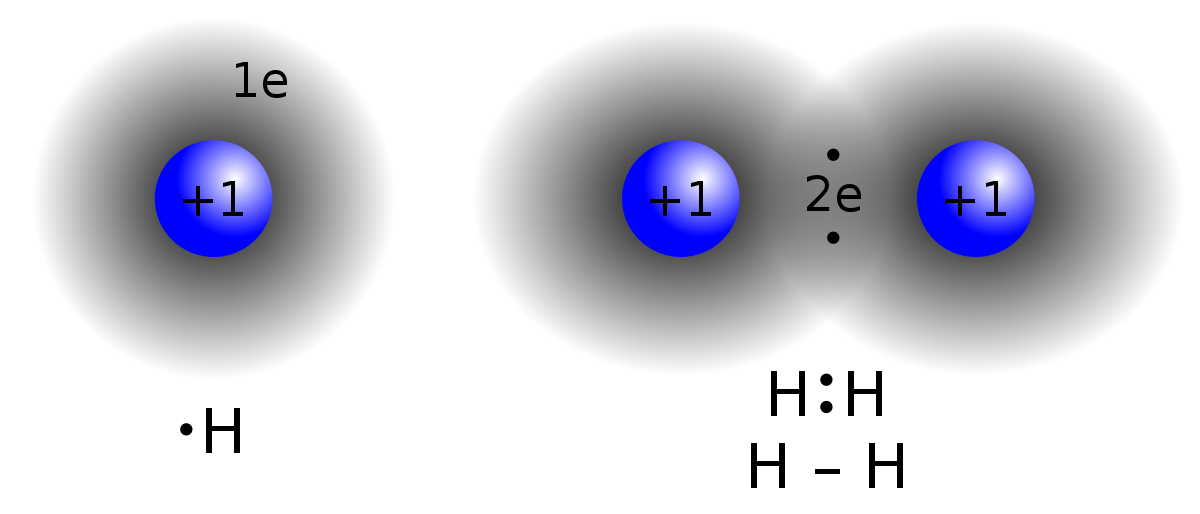
أوضح كيف تنشأ الرابطة التساهمية في جزيء الهيدروجين H2 . (العدد الذري للهيدروجين = 1).
تحتوي ذرة الهيدروجين على إلكترون واحد في مستوى الطاقة الخارجي.
انظر إلى تركيب لويس لذرة الهيدروجين:

ولكي يكتمل مستوى الطاقة الخارجي للهيدروجين بالإلكترونات، وتصل إلى حالة الاستقرار، فإنها بحاجة إلى إلكترون، فتتشارك ذرة الهيدروجين الأولى بإلكترون مع ذرة الهيدروجين الثانية فتتكون رابطة تساهمية.
مثال (2):
أوضح كيف تنشأ الرابطة التساهمية في جزيء الفلور F2 . (العدد الذري للفلور = 9).
تحتوي ذرة الفلور على (7) إلكترونات في مستوى الطاقة الخارجي.
9F : 2 , 7
ولكي يكتمل مستوى الطاقة الخارجي للفلور بالإلكترونات، وتصل إلى حالة الاستقرار، فإنها بحاجة إلى إلكترون، فتتشارك ذرة الفلور الأولى بإلكترون مع ذرة الفلور الثانية فتتكون بينهما رابطة تساهمية.
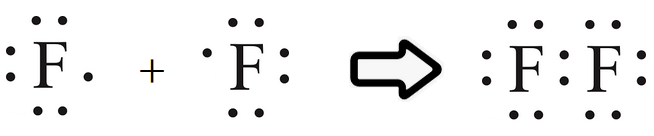
مثال (3):
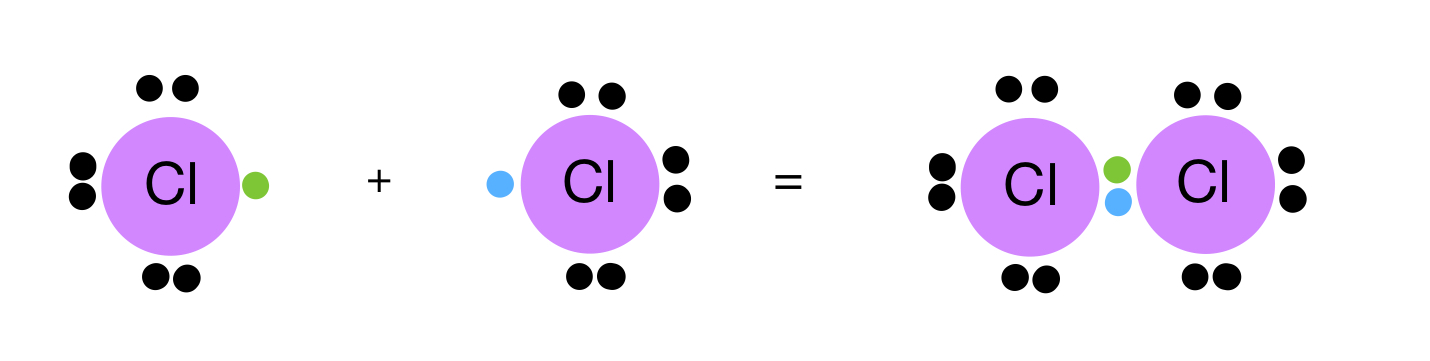
أوضح كيف تنشأ الرابطة التساهمية في جزيء الكلور Cl2 . (العدد الذري للكلور = 17).
تحتوي ذرة الكلور على (7) إلكترونات في مستوى الطاقة الخارجي.
17Cl : 2 , 8 , 7
ولكي يكتمل مستوى الطاقة الخارجي للكلور بالإلكترونات، وتصل إلى حالة الاستقرار، فإنها بحاجة إلى إلكترون، فتتشارك ذرة الكلور الأولى بإلكترون مع ذرة الكلور الثانية فتتكون بينهما رابطة تساهمية.
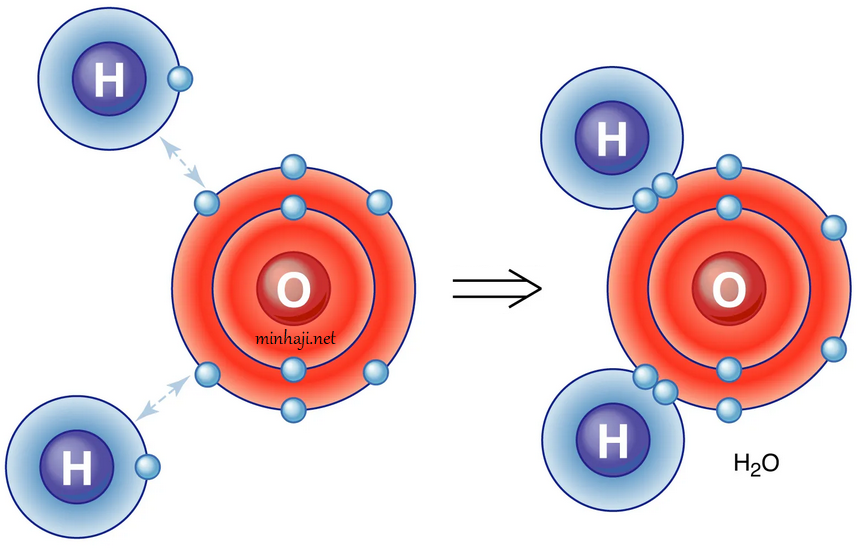
مثال (4):
أوضح كيف تنشأ الرابطة التساهمية في جزيء الماء H2O .
علماً بأن العدد الذري للهيدروجين = 1 ، والأكسجين = 8
التوزيع الإلكتروني لكلا الذرتين:
8O : 2 , 6
1H : 1
تحتاج ذرة الأكسجين إلى إلكترونين كي يكتمل مستوى الطاقة الخارجي بالإلكترونات وتصل إلى حالة الاستقرار، وتحتاج كل ذرة هيدروجين إلى إلكترون للوصول إلى حالة الاستقرار، لذا تقدم كل ذرة هيدروجين إلكترونها إلى ذرة الأكسجين فتتكون رابطتين تساهميتين.
الخصائص الفيزيائية للمركبات الأيونية والتساهمية
|
|
المركبات الأيونية |
المركبات التساهمية |
|
درجات الانصهار والغليان |
درجات غليانها وانصهارها مرتفعة لقوة التجاذب بين أيوناتها |
درجات غليانها وانصهارها منخفضة؛ لأن قوى التجاذب بين الجزيئات ضعيفة |
|
التوصيل الكهربائي |
محاليلها ومصاهيرها موصلة للتيار الكهربائي لاحتوائها على أيونات موجبة وسالبة |
غالبيتها غير موصلة للتيار الكهربائي |
إعداد : شبكة منهاجي التعليمية
31 / 03 / 2022
النقاشات