أسئلة المحتوى وإجاباتها
أتحقق صفحة (141):
1- أسمي المركب الآتي:

2، 3 – ثنائي ميثيل بيوتانال.
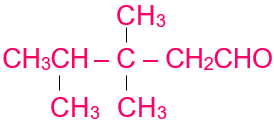
2- أكتب الصيغة البنائية للمركب الآتي:
3، 3، 4 – ثلاثي ميثيل بنتانال.
أفكر صفحة (141):
أحدد الخطأ في اسم المركب الآتي وأعيد تسميته:
6 – إيثيل هبتانال.

الخطأ: تحديد أطول سلسلة. الاسم الصحيح: 6 – ميثيل أوكتانال.
أتحقق صفحة (143):
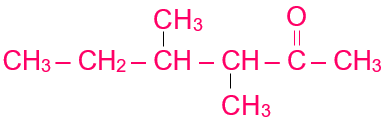
أكتب الصيغة البنائية للمركب الآتي:
3، 4 – ثنائي ميثيل -2- هكسانون.
أفكر صفحة (143):
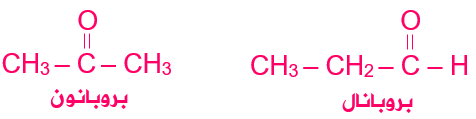
أكتب الصيغ البنائية لمتصاوغات الصيغة الجزيئية C3H6O وأسميها.
الصيغة الجزيئية احتمالان، إما ألدهيد أو كيتون.
أفكر صفحة (144):
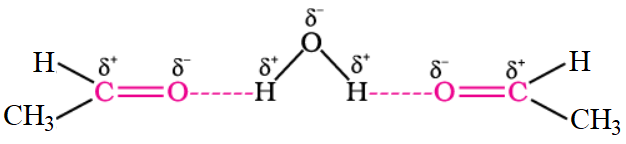
أرسم مخططاً يفسر ذوبان الإيثانال في الماء.
أتحقق صفحة (144):
1- أحدد المركب الذي له أعلى درجة غليان: 2- بنتانون أم 2- بنتانول.
2- بنتانول أعلى درجة غليان.
2- أتوقع المركب الأكثر ذائبية في الماء: CH3CH2CHO أم CH3(CH2)4CHO
الأكثر ذائبية هو: CH3CH2CHO
أتحقق صفحة (146):
أكتب الصيغة البنائية للمركب الآتي:
حمض -4- إيثيل هكسانويك.

أفكر صفحة (146):
أسمي المركب:
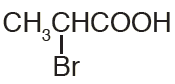
حمض 2- برومو بروبانويك.
أتحقق صفحة (148):
أي المركبين له أعلى درجة غليان:
حمض البروبانويك، أم حمض البيوتانويك؟ أفسر إجابتي.
حمض البيوتانويك أعلى درجة غليان؛ فكلا المركبين تترابط جزيئاتهما بروابط هيدروجينية على شكل ثنائيات، إلا أن عدد ذرات الكربون في حمض البيوتانويك أكبر، وكتلته المولية أكبر، وقوة التجاذب (قوى لندن) بين الثنائيات التي يشكلها أكبر ودرجة غليانه أعلى.
أفكر صفحة (148):
بالرجوع إلى الجدول (13) أفسر:
لماذا جرت مقارنة درجة غليان حمض البروبانويك بكحول 1- بيوتانول وليس 1- بروبانول.
لتساوي كتلتهما المولية، وبالتالي يظهر أثر العوامل الأخرى المؤثرة في درجة الغليان، وهي نوع قوى التجاذب، وكلاهما تترابط جزيئاته بروابط هيدروجينية، فيكون عدد الروابط الهيدروجينية هو العامل المؤثر الذي أدى إلى هذا الفرق الكبير في درجة الغليان.
أتحقق صفحة (150):
أكتب الصيغة البنائية للمادة المسؤولة عن رائحة الأناناس.
بيوتانوات الإيثيل. CH3CH2CH2COOCH2CH3
أفكر صفحة (150):
هل تشكل الحموض الكربوكسيلية والإسترات المتساوية في عدد ذرات الكربون متصاوغات؟ أبرر إجابتي؛ مستعيناً بمثال أطبقه على كل منهما.
نعم تشكل متصاوغات، لتشابههما في الصيغة الجزيئية وهي (CnH2nO).
مثال: للصيغة الجزيئية C2H4O2 متصاوغان، أحدهما حمض الإيثانويك والآخر ميثانوات الميثيل.
حمض الإيثانويك: CH3COOH ، ميثانوات الميثيل: HCOOCH3
أتحقق صفحة (151):
أحدد المركب الذي له أعلى درجة غليان:
1- CH3COOCH2CH2CH3 أم CH3CH2CH2COOH
CH3CH2CH2COOH
2- HCOOCH3 أم CH3COOCH3
CH3COOCH3
إعداد : شبكة منهاجي التعليمية
04 / 06 / 2022
النقاشات