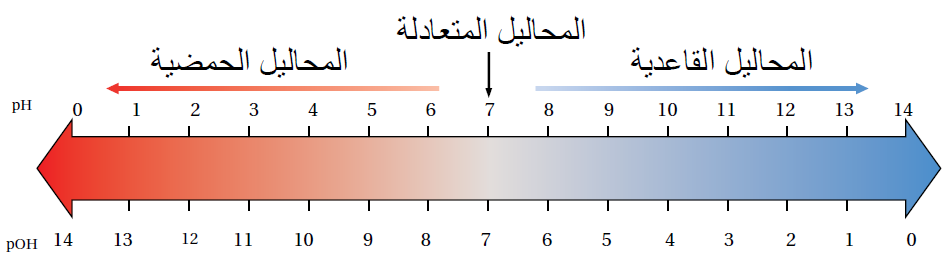
الرقم الهيدروكسيلي
pOH
يستخدم الرقم الهيدروكسيلي للتعبير عن قاعدية المحلول.
الرقم الهيدروكسيلي: اللوغاريتم السالب للأساس 10 لتركيز لتركيز أيون الهيدروكسيد OH- في المحلول.
أي أن:
pOH = - log [OH-]
ومن العلاقة السابقة يمكن اشتقاق العلاقة:
[OH-] = 10-pOH
العلاقة بين pH و pOH
pH + pOH = 14
مثال (1):
أحسب الرقم الهيدروكسيلي pOH والرقم الهيدروجيني pH لمحلول القاعدة KOH تركيزه 0.01 M
معادلة تأين القاعدة:
KOH K+ + OH-
[OH-] = [KOH] = 1 x 10-2 M
pOH = - log [OH-]
pOH = - log (1 x 10-2) = 2
pH = 14 – 2 = 12
مثال (2):
أحسب الرقم الهيدروجيني pH والرقم الهيدروكسيلي pOH لمحلول حمض الهيدروكلوريك HCl الذي تركيزه 10-3 M 1 x
pH = - log [H3O+]
pH = - log (1 x 10-3) = 3
pH + pOH = 14
pOH = 14 – 3 = 11
مثال (3):
أحسب [OH-] و [H3O+] لعبوة من حليب المغنيسيا مكتوب عليها الرقم الهيدروكسيلي pOH يساوي 4 .
[OH-] = 10-pOH = 10-4 = 1 x 10-4 M
[H3O+] [OH-] = 1 x 10-14 Kw =
[H3O+] = = = 1 x 10-10 M
سؤال (1):
1- أحسب الرقم الهيدروكسيلي pOH لمحلول هيدروكسيد الليثيوم LiOH تركيزه 0.004 M
(علماً أن log 4 = 0.6).
2- أحسب [OH-] لعبوة مكتوب عليها أن الرقم الهيدروكسيلي pOH يساوي 3.2 (علماً أن log 6.3 = 0.8).
سؤال (2):
أحسب كلاً من pH و pOH لكل من المحاليل الآتية:
1- محلول تركيز أيونات H3O+ فيه يساوي 10-5 M
2- محلول تركيز أيونات OH- فيه يساوي 10-4 M
سؤال (3):
أكمل الفراغات في الجدول الآتي:
|
المحلول |
[H3O+] (M) |
[OH-] (M) |
pH |
pOH |
طبيعة المحلول |
|
1 |
1 |
|
|
|
|
|
2 |
|
1 x 10-6 |
|
|
|
|
3 |
|
|
2 |
|
|
|
4 |
|
|
|
|
متعادل |
سؤال (4):
إذا علمت أن نسبة في أحد المحاليل = 2.5 فاحسب قيمة pOH في المحلول.
إعداد : أ. أحمد الحسين
16 / 09 / 2024
النقاشات