مقدمة
صفات عامة للحموض
- تؤثر في الكواشف مثل تبّاع الشمس، فتحوّل لونه الأزرق إلى اللون الأحمر.
- محاليلها المائية موصلة للتيار الكهربائي (محاليلها كهرلية أو إلكتروليتية).
- طعمها حمضي أو لاذع.
- تتفاعل الحموض مع الفلزات النشطة ويتصاعد غاز الهيدروجين، وتزداد شدة تصاعد الغاز بزيادة قوة الحمض.
تحتوي بعض المواد الغذائية على حموض، كحمض الستريك الموجود في الليمون والبرتقال والبندورة.
أمثلة على الحموض وصيغها وأماكن وجودها واستخداماتها:
- حمض الكربونيك H2CO3 ويوجد في المشروبات الغازية.
- حمض الهيدروكلوريك HCl وتفرزه المعدة للمساعدة في هضم البروتين وتنشيط إنزيمات الهضم وقتل الجراثيم، مع قدرة جدار المعدة على حماية المعدة عن طريق الإفراز المستمر للغشاء المخاطي، إضافة إلى قدرة النسيج الطلائي على التجدد باستمرار.
- حمض الكبريتيك H2SO4 ويوجد في بطارية الرصاص ويستخدم في زيادة حموض التربة، ومعالجة ملوحتها، وتطهيرها من الفطريات، وقد اكتشفه جابر بن حيان وأطلق عليه اسم زيت الزاج.
- حمض الإيثانويك (الأسيتيك، الخليك) CH3COOH ويوجد في الخل.
- حمض الميثانويك (الفورميك) HCOOH ويستخدمه النمل في الدفاع عن نفسه، ومطهراً لأعشاشه وصغاره، ولإرشاده أثناء عودته إلى مسكنه.

تعتمد قوة الحمض على مقدار ما يتأين (يتفكك) منه في الماء.
صيغ أشهر الحموض القوية:

سؤال (1):
الشكل أدناه يمثل مخططاً لجهاز قياس إيصالية محاليل المواد الإلكتروليتية للتيار الكهربائي.
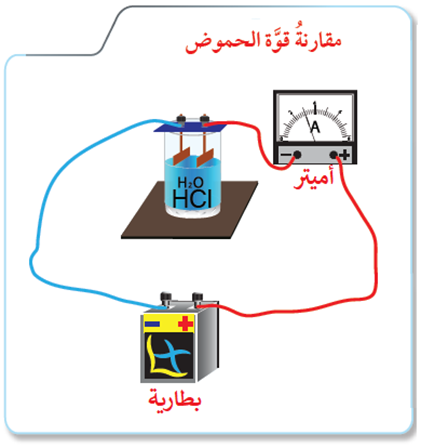
ضع في الكأس محلول حمض HCl بتركيز (0.1 M) مرة، ومحلول حمض CH3COOH بتركيز (0.1 M) مرة أخرى، ثم راقب مؤشر الأميتر.
1- أي المحلولين أكثر إيصالية للتيار الكهربائي؟
2- أي المحلولين يطلق كمية غاز H2 أكثر عند تفاعل كتل متساوية من المغنيسيوم معهما؟
صفات عامة للقواعد
- تؤثر في الكواشف فتحول لون ورقة تبّاع الشمس من الأحمر إلى اللون الأزرق.
- محاليلها المائية موصلة للتيار الكهربائي (محاليلها كهرلية أو إلكتروليتية).
- طعمها مرّ.
- ملمسها زلق؛ ولأن ملمسها زلق تستخدم بعض القواعد، مثل هيدروكسيد الصوديوم والليثيوم في صناعة الشحوم الصابونية (الشحمة)، حيث تضاف إلى الدهون الحيوانية والنباتية لصناعة الصابون الشحمي الذي يستخدم في تشحيم الآلات كالصابون الليثيومي والصابون الصوديومي.
تحتوي بعض المواد الغذائية على قواعد، مثل:
- القواعد الموجودة في بعض الخضراوات كالسبانخ والبروكلي والخيار.
- القواعد الموجودة في بعض الفواكه كالتفاح والمشمش والفراولة.

أمثلة على القواعد وصيغها وأماكن وجودها واستخداماتها:
- هيدروكسيد الصوديوم NaOH ويستخدم في صناعة المنظفات المنزلية والصابون ومساحيق الغسيل وسائل الجلي.
- هيدروكسيد الكالسيوم Ca(OH)2 ويستخدم صناعة الإسمنت، ومعالجة مياه الصرف الصحي، ومعالجة حموضة التربة الزراعية، ويضاف للعلف لتحسين تغذية المواشي.
- هيدروكسيد المغنيسيوم Mg(OH)2 ويسمى حليب المغنيسيا؛ وهو محلول معلق يستخدم في علاج الإمساك وعسر الهضم وحرقة المعدة.
- الأمونياNH3
- الأمينات RNH2 ، ومن أمثلتها المستخلص المر في لحاء الكينا يحتوي على مركب الكينين وينتمي للأمينات، وقد استخدم في مكافحة الملاريا.

تعتمد قوة القاعدة على مقدار ما يتأين (يتفكك) منها في الماء.
صيغ أشهر القواعد القوية:

سؤال (2):
أنبوب اختبار (1) يحتوي على (3 mL) محلول حمض HCl بتركيز (0.1 M).
أنبوب اختبار (2) يحتوي على (3 mL) محلول هيدروكسيد الصوديوم NaOH بتركيز (0.1 M).
1- ما التغير اللوني عند وضع ورقة تبّاع شمس حمراء في كلا الأنبوبين؟
2- ما التغير اللوني عند وضع ورقة تبّاع شمس زرقاء في كلا الأنبوبين؟
3- عند مزج محتويات الأنبوبين في أنبوب اختبار ثالث:
- ما المادة الرئيسة التي تنتج من تفاعلها؟
- ماذا الاسم الذي يطلق على التفاعل بينهما؟
- هل يحدث تغير على درجة الحرارة؟
إعداد : شبكة منهاجي التعليمية
14 / 08 / 2024
النقاشات