أسئلة وزارية (الكيمياء الحركية)
الدورات (1997-2000)
دورة 1997
أ- انقل الإجابة الصحيحة للفقرة الآتية إلى دفتر إجابتك:
إن إضافة العامل المساعد إلى التفاعل الكيميائي يعمل على زيادة:
أ- ΔH للتفاعل.
ب- طاقة التنشيط للتفاعل.
ج- طاقة الوضع للمواد المتفاعلة.
د- سرعة التفاعل.
ب- اعتماداً على البيانات الواردة في الجدول الآتي للتفاعل: 2A (g) + 2B (g) → C (g) + 2D (g)
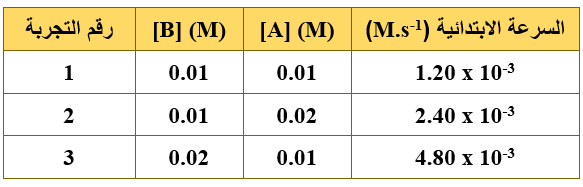
1- احسب رتبة التفاعل بالنسبة إلى المادة A .
من خلال التجربتين (1 , 2) نلاحظ أن تركيز A تضاعف مرتين وتضاعفت السرعة مرتين عند ثبات تركيز B ؛ إذن رتبة المادة A هي (1).
2- احسب رتبة التفاعل بالنسبة إلى المادة B .
من خلال التجربتين (1 , 3) نلاحظ أن تركيز B تضاعف مرتين وتضاعفت السرعة (4) مرات عند ثبات تركيز A ؛ إذن رتبة المادة B هي (2).
3- اكتب قانون السرعة للتفاعل السابق.
R = k [A]1 [B]2
4- احسب قيمة ثابت سرعة التفاعل السابق (k) مع ذكر وحدته.
نعوض معطيات أي من التجارب الثلاث في قانون السرعة:
R = k [A]1 [B]2
1.2 x 10-3 = k (0.01)1 (0.01)2
k = 1.2 x 103 M-2.s-1
5- ما أثر زيادة درجة الحرارة على قيمة ثابت السرعة (k)؟
تزداد قيمة ثابت السرعة بزيادة درجة الحرارة.
ج- يتفاعل H2 مع ICl عند درجة حرارة معينة وفق المعادلة: 2ICl + H2 → I2 + 2HCl
جد العلاقة بين سرعة تكوين I2 وسرعة تكوين HCl في الفترة الزمنية نفسها للتفاعل.
سرعة تكوين I2 = سرعة تكوين HCl
دورة 1998
أ- انقل الإجابة الصحيحة للفقرة الآتية إلى دفتر إجابتك:
العبارة الصحيحة التي تتفق وطاقة التنشيط هي:
أ- تزداد طاقة التنشيط بارتفاع درجة الحرارة.
ب- تقل سرعة التفاعل بزيادة طاقة التنشيط.
ج- طاقة التنشيط تساوي طاقة المعقد المنشط.
د- طاقتا التنشيط للتفاعلين الأمامي والعكسي متساويتان.
ب- يتفاعل الماء مع CH3Cl حسب المعادلة التالية:
CH3Cl + H2O → CH3OH + HCl
إذا علمت أن سرعة التفاعل تتضاعف مرتين عند مضاعفة تركيز CH3Cl مرتين، كما تتضاعف السرعة أربع مرات عند مضاعفة تركيز H2O مرتين.
أجب عما يأتي:
1- احسب رتبة التفاعل بالنسبة لكل من المادتين H2O , CH3Cl .
رتبة CH3Cl = (1) ورتبة H2O = (2).
2- اكتب قانون سرعة التفاعل.
R = k [CH3Cl]1 [H2O]2
3- إذا كانت سرعة التفاعل = 1.5 M.s-1، عندما يكون [H2O] = 0.2 M = [CH3Cl] . احسب قيمة ثابت سرعة التفاعل (k).
R = k [CH3Cl]1 [H2O]2
1.5 = k (0.2)1 (0.2)2
k = 187.5 M-2.s-1
ج- إذا كان لديك معادلة التفاعل: 2NO + 2H2 → N2 + 2H2O
احسب سرعة استهلاك NO إذا كانت سرعة تكوين N2 = 0.6 M/s
سرعة استهلاك NO = سرعة تكوين N2
سرعة استهلاك NO = 2 × سرعة تكوين N2
سرعة استهلاك NO = 2 × 0,6
سرعة استهلاك NO = 1.2 M/s
دورة 1999
أ) انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة للفقرات الآتية:
1- في التفاعل العام الآتي:2NO2 + F2 → 2NO2F ، إذا كانت سرعة استهلاك F2 0.2 M/s = فإن سرعة إنتاج NO2F (M/s) تساوي:
أ) 0.1
ب) 0.2
ج) 0.4
د) 0.6
2- تزداد سرعة التفاعل عند رفع درجة الحرارة بسبب:
أ) نقصان ثابت سرعة التفاعل
ب) زيادة عدد التصادمات الفعالة.
ج) نقصان طاقة التنشيط.
د) زيادة طاقة المعقد المنشط.
ب) إذا علمت أن قانون السرعة للتفاعل التالي:
CO (g) + NO2 (g) → CO2 (g) + NO (g)
هو R = k [NO2]2
أجب عما يأتي:
1- ما رتبة التفاعل بالنسبة للمادة CO؟
صفرية.
2- إذا كانت سرعة التفاعل = 2 x 10-5 M/min، عندما [CO]=[NO2] = 0.2 M. احسب قيمة ثابت السرعة k .
R = k [NO2]2
2 x 10-5 = k (0.2)2
k = 5 x 10-4 M-1.s-1
ج)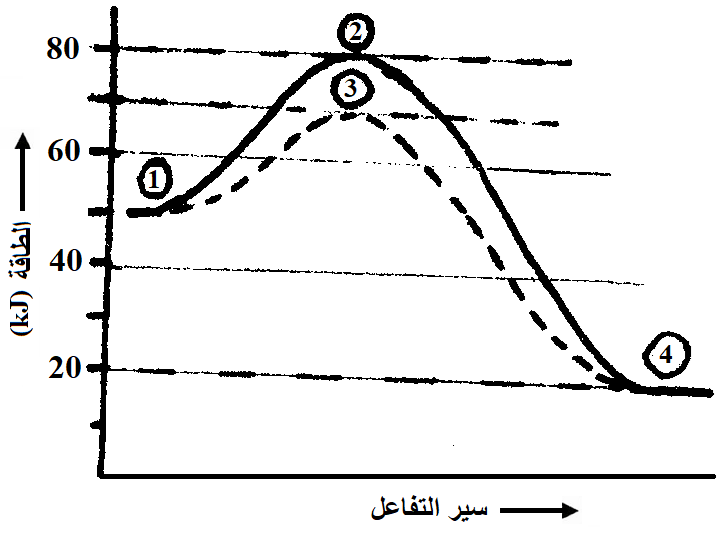 الشكل المجاور يمثل منحنى طاقة التفاعل: A2 (g) + B2 (g) 2AB (g) بوجود وبدون العامل المساعد Fe(s) . ادرس الشكل ثم أجب عما يأتي:
الشكل المجاور يمثل منحنى طاقة التفاعل: A2 (g) + B2 (g) 2AB (g) بوجود وبدون العامل المساعد Fe(s) . ادرس الشكل ثم أجب عما يأتي:
1- إلى ماذا تشير الأرقام (1 ، 2)؟
الرقم (1) يشير إلى المتفاعلات، الرقم (2) يشير إلى المعقد المنشط بدون عامل مساعد.
2- ما مقدار طاقة التنشيط للتفاعل الأمامي دون عامل مساعد؟
30 kJ
3- ما مقدار طاقة المعقد المنشط عند وجود العامل المساعد؟
70 kJ
4- أيهما أسرع تفاعلاً تكوّن AB أم تفككه؟
تكوّن AB
دورة 2000
أ) انقل إلى دفتر إجابتك الفقرة الآتية والإجابة الصحيحة لها:
إذا كان قانون سرعة التفاعل[2NO + 2H2 → N2 + 2H2O] هو: R = k [NO]2 [H2]1 ، وانخفض حجم وعاء التفاعل إلى النصف، فإن سرعة التفاعل تزداد بمقدار:
أ) مرتين.
ب) 4 مرات.
ج) 8 مرات.
د) 16 مرة.
ب) في التفاعل الافتراضي الآتي:2A + B 2C ، إذا علمت أن:
* طاقة المواد المتفاعلة = 240 kJ. * طاقة المواد الناتجة = 20 kJ.
* طاقة التنشيط للتفاعل الأمامي = 10 kJ.
أجب عما يأتي:
1- ما قيمة طاقة التنشيط للتفاعل العكسي؟
230 kJ
2- ما قيمة طاقة المعقد المنشط؟
250 kJ
3- ما أثر زيادة درجة الحرارة على قيمة طاقة التنشيط للتفاعل الأمامي؟ (تزيد، تقل، تبقى ثابتة)؟
تبقى ثابتة.
ج) يتحلل H2O2 وفق المعادلة: 2H2O2 → 2H2O + O2
ما سرعة تكوين H2O إذا كانت سرعة تكوين 0.02 M/s = O2 ؟
0.04 M/s
إعداد : شبكة منهاجي التعليمية
27 / 03 / 2023
النقاشات