حساب جهد الخلية Eocell
لحساب جهد الخلية المعياري من جدول جهود الاختزال، استخرج جهود اختزال العنصرين، ثم طبّق العلاقة التالية:
جهد الخلية المعياري (Eo) = جهد اختزال المهبط - جهد اختزال المصعد.
Eocell = Eoreduction (cathode) – Eoreduction (anode)
ملاحظات:
- جهد الخلية المحسوب يجب أن يكون موجباً.
- قيمة (Eo) للمعادلة لا تتأثر بالضرب عند الموازنة؛ لأن جهود الاختزال تعتمد على نوع المادة وليس على كميتها (عدد مولاتها).
مثال (1):
أحسب جهد الخلية المعيارية للخلية الجلفانية التي يحدث فيها التفاعل الآتي:
Co2+(aq) + Fe(s) → Co(s) + Fe2+(aq)
إذا علمت أن:
Fe2+(aq) + 2e- → Fe(s) EoFe = - 0.44 V
Co2+(aq) + 2e- → Co(s) EoCo = - 0.28 V
الحل:
يلاحظ من المعادلة أن الحديد قد تأكسد، فهو بذلك المصعد، وأن أيونات الكوبالت قد اختزلت، فبذلك يكون الكوبالت هو المهبط.
ويمكن استنتاج أن الكوبالت هو المهبط؛ لأن جهد اختزال أيوناته أعلى من جهد اختزال أيونات الحديد.
Eocell = Eo(cathode) – Eo(anode)
E0cell = - 0.28 – (- 0.44) = + 0.16 V
مثال (2):
خلية جلفانية مكونة من نصف خلية الفضة Ag│Ag+ ونصف خلية المغنيسيوم Mg│Mg2+ في الظروف المعيارية. أحسب جهد الخلية المعياري، وأكتب المعادلة الكلية إذا علمت أن:
Mg2+(aq) + 2e- → Mg(s) EoMg = - 2.37 V
Ag+(aq) + e- → Ag(s) EoAg = + 0.80 V
الحل:
يلاحظ أن جهد اختزال الفضة أعلى من جهد اختزال المغنيسيوم، لذا يكون قطب الفضة هو المهبط.
Eocell = Eo(cathode) – Eo(anode)
Eocell = + 0.80 – (- 2.37) = + 3.17 V
ولكتابة المعادلة الكلية، أقلب معادلة المغنيسيوم (المصعد)، وأضرب معادلة الفضة (المهبط) في (2):
Mg(s) → Mg2+(aq) + 2e-
2Ag+(aq) + 2e- → 2Ag(s)
أجمع المعادلتين:
Mg(s) + 2Ag+(aq) → Mg2+(aq) + 2Ag(s)
سؤال (1):
أحسب (Eocell) للخلية الجلفانية التي تعمل وفق المعادلة:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
إذا علمت أن:
Cu2+(aq) + 2e- → Cu(s) EoCu = + 0.34 V
Zn2+(aq) + 2e- → Zn(s) EoZn = - 0.76 V
سؤال (2):
اعتماداً على جهود الاختزال المعيارية لنصفي التفاعلين التاليين، أجيب عما يلي:
Sn2+(aq) + 2e- → Sn(s) EoSn = - 0.14 V
Ag+(aq) + e- → Ag(s) EoAg = + 0.80 V
1- أي القطبين يمثل المصعد؟ وما شحنته؟
2- أكتب معادلة نصف التفاعل الذي يحدث عند كل قطب في خلية (فضة ـ قصدير).
3- أكتب معادلة التفاعل الكلي الموزون.
4- أحسب قيمة جهد الخلية المعياري (Eocell).
سؤال (3):
أدرس الجدول التالي، ثم أجيب عن الأسئلة التي تليه:

1- عند عمل خلية (نحاس - فضة)، أحدد القطب الذي يمثل المهبط، وما شحنته؟
2- أي فلزين يمكن ربطهما معاً لتكوين خلية جلفانية تعطي أكبر فرق جهد؟
3- أي فلزين يمكن ربطهما معاً لتكوين خلية جلفانية تعطي أقل فرق جهد؟
4- أحسب جهد الخلية المعياري للخلية المكونة من قطبي Cu و Al .
5- أكتب معادلة المصعد في الخلية الجلفانية المكونة من Ag و Pb .
6- أختار فلزاً يكوّن مع النحاس خلية جلفانية جهدها المعياري 0.74 V
7- أكتب المعادلة الكلية في خلية (Cd - Al).
8- ما قيمة جهد تأكسد الفضة؟
سؤال 4 :
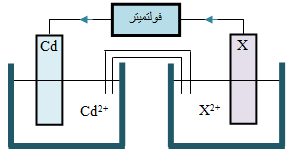 لديك الخلية الجلفانية المجاورة:
لديك الخلية الجلفانية المجاورة:
أجب عن الأسئلة الآتية:
1- أي الفلزات من جدول جهود الاختزال أدناه يمكن استخدامه بدلاً من القطب X لتتحرك الإلكترونات كما في الشكل المجاور؟

2- أحسب جهد الخلية المعياري.
3- ماذا يحدث لتركيز أيونات X2+ في محلوله؟
4- أي القطبين تزداد كتلته؟
سؤال 5 :
استخدم طالب عدداً من الأقطاب الفلزية لعمل خلايا غلفانية في الظروف المعيارية:

وفيما يأتي جدولان، الجدول الأيمن يبين أزواج الفلزات المستخدمة في أربعة تجارب مختلفة، والجدول الأيسر يبين جهود الاختزال المعيارية للفلزات المستخدمة كأقطاب في كل خلية:

أستخدم جهود الاختزال من الجدول الأيسر للإجابة عن الأسئلة التالية:
1- أوضح اتجاه حركة الإلكترونات في الدارة الخارجية في التجربة رقم (2).
1- أحدد رقم التجربة التي تكون قيمة (Eocell) للخلية أكبر ما يمكن.
3- أي القطبين: ( A أم B ) يكون المهبط في التجربة رقم (1)؟
4- أكتب معادلة نصف التفاعل الذي يحدث عند القطب A في التجربة رقم (4).
5- أذكر اسم محلول يمكن استخدامه في الأنبوب X.
6- أي القطبين: ( A أم B ) ستنقص كتلته في التجربة رقم (3)؟
7- ماذا يحدث لتركيز الأيونات B2+ في التجربة رقم (2)؟
سؤال (6):
التفاعلين التاليين يمثلان جهود التأكسد المعيارية في خلية (ألمنيوم ـ كروم):
Al(s) → Al3+(aq) + 3e- Eo = 1.66 V
Cr(s) → Cr3+(aq) + 3e- Eo = 0.74 V
1- أكتب معادلة نصف التفاعل الذي يحدث عند كل قطب.
2- أي القطبين المصعد؟ وما شحنته؟
3- أحسب قيمة جهد هذه الخلية المعياري (Eocell).
سؤال (7):
تُختزل أيونات النحاس Cu2+ بوساطة Fe وفق المعادلة:
Fe(s) + Cu2+(aq) → Fe2+(aq) + Cu(s)
فإذا علمت أن قيمة (Eocell) للخلية +0.74 V ، وأن جهد الاختزال المعياري للنحاس Eo يساوي 0.34 V ، فما قيمة (oE) لنصف التفاعل التالي:
Fe(s) → Fe2+(aq) + 2e-
إعداد : شبكة منهاجي التعليمية
22 / 06 / 2023
النقاشات