الرابطة التساهمية الأحادية
تنشأ الرابطة التساهمية الأحادية عندما تتشارك ذرتان بزوج رابط من الإلكترونات.
مثال (1):
أكتب تركيب لويس لجزيء NF3 ، وأحدد عدد أزواج الإلكترونات الرابطة وغير الرابطة حول الذرة المركزية. (العدد الذري لذرة N = 7 ، وللذرة F = 9).
الذرة المركزية: الذرة الأقل عدداً في الجزيء المكون من أكثر من ذرتين وتكون أكثر من رابطة واحدة.
الحل:
أولاً: أحدد عدد إلكترونات التكافؤ لذرات الجزيء:

ثانياً: أحسب عدد إلكترونات التكافؤ الكلي لجميع ذرات الجزيء:
عدد إلكترونات التكافؤ الكلي = (عدد إلكترونات تكافؤ N × عدد ذراته) + (عدد إلكترونات تكافؤ F × عدد ذراته)
Total (v.e) = (5 x 1) + (7 x 3) = 26e-
ثالثاً: أحسب عدد أزواج إلكترونات التكافؤ (v.e.p):
(v.e.p) = = 13
رابعاً: أوزع ذرات F حول الذرة المركزية N ، وأرسم رابطة أحادية بين ذرة النيتروجين وذرات الفلور، وتمثل كل رابطة زوج رابط من الإلكترونات (b.e.p).

خامساً: أحسب عدد أزواج الإلكترونات المتبقية (l.e.p) وتساوي:
n(l.e.p) = n(v.e.p) – n(b.e.p) = 13 – 3 = 10
سادساً: أوزع الأزواج المتبقية على ذرات الفلور والنيتروجين بحيث أحقق قاعدة الثمانية:

وتمثل الأزواج المتبقية الأزواج غير الرابطة من الإلكترونات.
- عدد أزواج الإلكترونات الرابطة: (3) أزواج.
- عدد أزواج الإلكترونات غير الرابطة على الذرة المركزية: (1) زوج.
- عدد أزواج الإلكترونات غير الرابطة على كل ذرة فلور: (3) أزواج.
- عدد أزواج الإلكترونات غير الرابطة في الجزيء: (10) أزواج.
مثال (2):
أكتب تركيب لويس لجزيء GeCl4 ، وأحدد عدد أزواج الإلكترونات الرابطة وغير الرابطة حول الذرة المركزية. علماً بأن عدد إلكترونات تكافؤ Ge = 4 ، و Cl = 7
الحل:
أولاً: أحدد عدد الإلكترونات التكافؤ الكلي لجميع ذرات الجزيء:
عدد إلكترونات التكافؤ الكلي = (عدد إلكترونات تكافؤ Ge × عدد ذراته) + (عدد إلكترونات تكافؤ Cl × عدد ذراته)
Total (v.e) = (4 x 1) + (7 x 4) = 32e-
ثانياً: أحسب عدد أزواج إلكترونات التكافؤ (v.e.p):
(v.e.p) = = 16
ثالثاً: أوزع ذرات Cl حول الذرة المركزية Ge ، وأرسم رابطة أحادية بين ذرة الجرمانيوم وذرات الكلور، وتمثل كل رابطة زوج رابط من الإلكترونات (b.e.p).
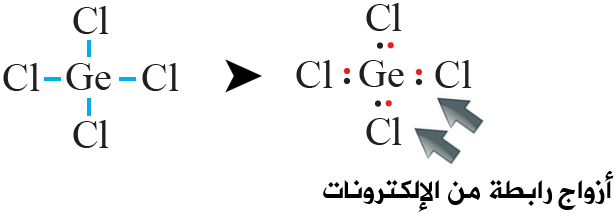
رابعاً: أحسب عدد أزواج الإلكترونات المتبقية (l.e.p) وتساوي:
n(l.e.p) = n(v.e.p) – n(b.e.p) = 16 – 4 = 12
خامساً: أوزع الأزواج المتبقية على ذرات الكلور بحيث أحقق قاعدة الثمانية:
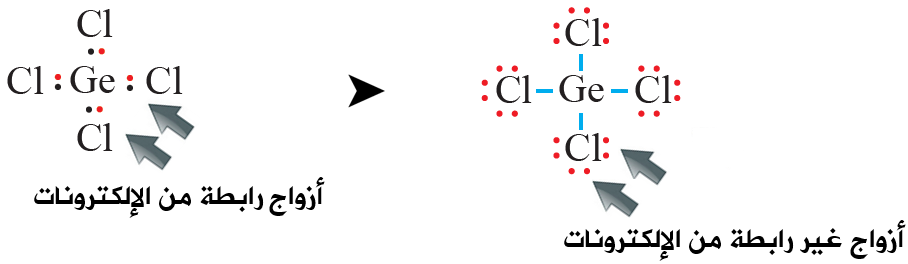
- عدد أزواج الإلكترونات الرابطة: (4) أزواج.
- عدد أزواج الإلكترونات غير الرابطة على الذرة المركزية: (0) زوج.
- عدد أزواج الإلكترونات غير الرابطة على كل ذرة كلور: (3) أزواج.
- عدد أزواج الإلكترونات غير الرابطة في الجزيء: (12) أزواج.
مثال (3):
أكتب تركيب لويس لجزيء الإيثان C2H6 . (العدد الذري لذرة C = 6 ، وللذرة H = 1).
الحل:
أولاً: أحدد عدد إلكترونات التكافؤ لذرات الجزيء:

ثانياً: أحسب عدد الإلكترونات التكافؤ الكلي لجميع ذرات الجزيء:
عدد إلكترونات التكافؤ الكلي = (عدد إلكترونات تكافؤ C × عدد ذراته) + (عدد إلكترونات تكافؤ H × عدد ذراته)
Total (v.e) = (4 x 2) + (1 x 6) = 14e-
ثالثاً: أحسب عدد أزواج إلكترونات التكافؤ (v.e.p):
n(v.e.p) = = 7
رابعاً: أوزع ذرات H حول الذرتين المركزيتين C ، وأرسم رابطة أحادية بين ذرات الكربون وذرات الهيدروجين، ورابطة أحادية بين ذرتي الكربون، وتمثل كل رابطة زوج رابط من الإلكترونات (b.e.p).

خامساً: أحسب عدد أزواج الإلكترونات المتبقية (l.e.p) وتساوي:
n(l.e.p) = n(v.e.p) – n(b.e.p) = 7 – 7 = 0
لاحظ أنه لم يتبق أزواج من الإلكترونات، أي أن الجزيء لا يحتوي على أزواج غير رابطة من الإلكترونات.

إعداد : شبكة منهاجي التعليمية
03 / 07 / 2024
النقاشات