التهجين من نوع sp3
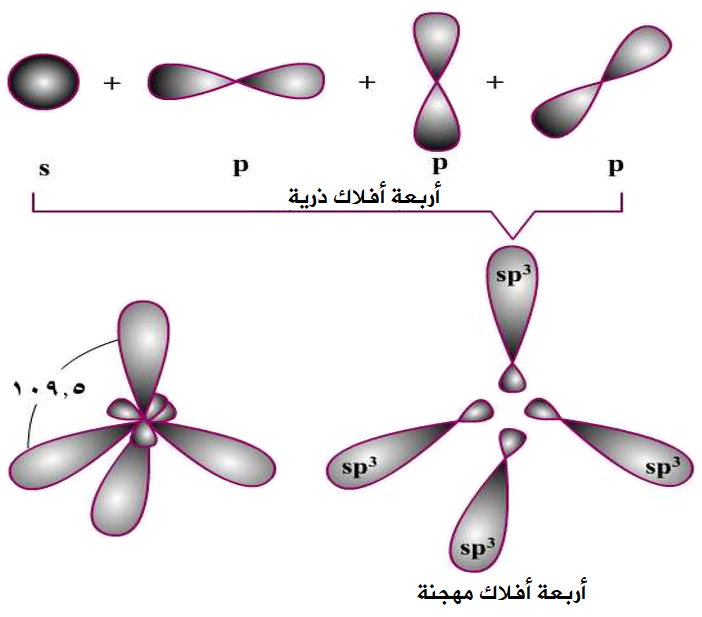
تجري الذرات المركزية تهجيناً من نوع sp3 إذا اختلط فلك من نوع s من الذرة المركزية، مع ثلاثة أفلاك من نوع p من الذرة نفسها، فتتكون أربعة أفلاك مهجنة من نوع sp3 وتتجه الأفلاك المهجنة في الفراغ بحيث يكون التنافر بين إلكتروناتها أقل ما يمكن فتأخذ شكل رباعي الأوجه، والزاوية فيما بينها 109.5o .
مثال: جزيء CH4
انظر إلى التوزيع الإلكتروني لذرة الكربون المركزية:
6C :[He] 2s2 2p2
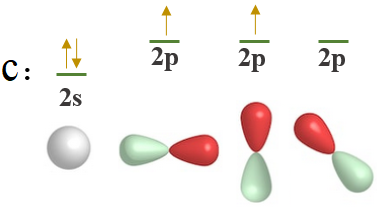
ومن التوزيع الإلكتروني تلاحظ أن ذرة الكربون تحتوي على إلكترونين منفردين، لذا فهي تميل للارتباط بذرتي هيدروجين فقط، حسب نظرية رابطة التكافؤ، والتي تحدد من خلالها عدد الروابط من خلال عدد الإلكترونات المنفردة.
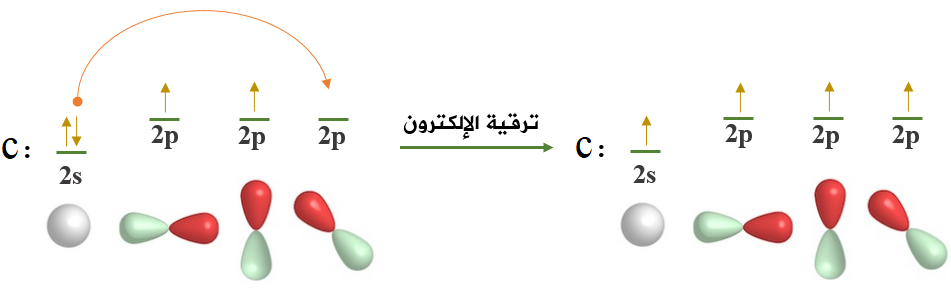
ولكي ترتبط ذرة الكربون بأربع ذرات هيدروجين، يجب أن يكون لديها أربعة إلكترونات منفردة، وعليه تقوم ذرة الكربون بعمل ترقية للإلكترون من المستوى الفرعي 2s إلى الفلك الفارغ في المستوى الفرعي 2p .
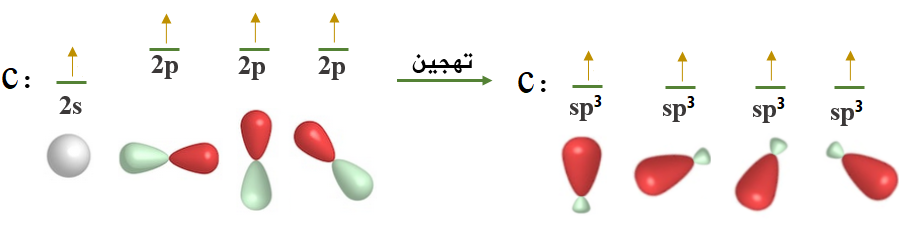
ولكي تكوّن ذرة الكربون أربع روابط متكافئة مع أربع ذرات هيدروجين تقوم بمساواة طاقة الأفلاك التي تحتوي على إلكترونات منفردة، وتخلطها معاً لتكوين أربعة أفلاك مهجنة يسمى كلّ واحد منها sp3 .
تتجه الأفلاك المهجنة في الفراغ بأربع اتجاهات بحيث يكون التنافر بين إلكتروناتها أقل ما يمكن وتأخذ الأفلاك شكل رباعي الأوجه منتظم، والزاوية 109.5o .

ثم تقدّم كلّ ذرة هيدروجين فلكاً ذرياً من نوع 1s .

- نوع التهجين الذي تجريه ذرة الكربون: sp3
- عدد الأفلاك المهجنة في ذرة الكربون: 4
- الشكل الهندسي (البنائي) للجزيء: رباعي الأوجه منتظم.
- قيمة الزاوية بين الأفلاك المهجنة: 109.5o .
- نوع الأفلاك الداخلة في تكوين الرابطة sp3-s : C-H .
- مبررات التهجين: تفسير عدد الروابط، وتفسير الزاوية بين الأفلاك المهجنة.
إعداد : شبكة منهاجي التعليمية
03 / 07 / 2024
النقاشات