تخفيف المحاليل
عند إضافة كمية من المذيب إلى محلول يحتوي على مذاب، فإن حجم المحلول سيزداد ويقل تركيزه، ولكن عدد مولات المذاب يبقى ثابتاً.
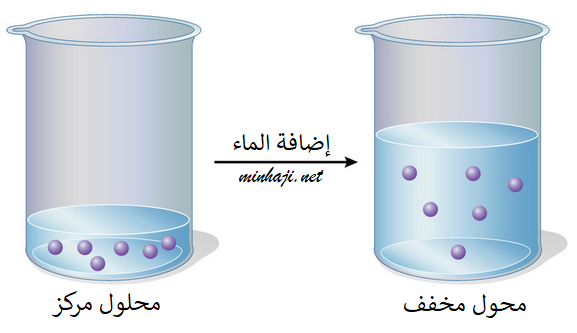
وعليه فإن:
عدد المولات قبل التخفيف = عدد المولات بعد التخفيف
وبما أن:
n =
فإن:
(التركيز × الحجم) قبل التخفيف = ( التركيز × الحجم) بعد التخفيف
M1 x V1 = M2 x V2
وتعرف العلاقة السابقة بقانون التخفيف.
مثال (1):
أحسب تركيز NaOH في محلول تم تحضيره بإضافة 150 mL من الماء المقطر إلى محلول NaOH حجمه 100 mL وتركيزه 0.2 mol/L .
تحليل السؤال (المعطيات)
M1 = 0.2 mol/L
M2 = ??
V1 = 100 mL
+ 150 mL = 250 mL V2 = 100 mL
الحل:
M1 x V1 = M2 x V2
0.2 x 100 = M2 x 250
M2 = 0.08 mol/L
مثال (2):
أحسب حجم حمض الكبريت (VI) المركز (18 mol/L) الذي يلزم لتحضير محلول مخفف للحمض حجمه 250 mL وتركيزه (1.8 mol/L).
تحليل السؤال (المعطيات)
M1 = 18 mol/L
M2 = 1.8 mol/L
V1 = ??
250 mL V2 =
الحل:
M1 x V1 = M2 x V2
18 x V1 = 1.8 x 250
V1 = 25 mL
ولتحضير المحلول المخفف نأخذ بالماصة 25 mL من الحمض المركز ونضيه للماء في دورق حجمي، ونكمل الحجم إلى 250 mL.
مثال (3):
احتاج طالب في إحدى التجارب إلى محلول من KOH حجمه 300 mL وتركيزه 0.1 mol/L، فإذا كان لديه محلول مركز من KOH تركيزه 6 mol/L، فكم مللتراً يلزم من المحلول المركز للحصول على المحلول المطلوب؟
تحليل السؤال (المعطيات)
M1 = 6 mol/L
M2 = 0.1 mol/L
V1 = ??
300 mL V2 =
الحل:
M1 x V1 = M2 x V2
6 x V1 = 0.1 x 300
V1 = 5 mL
ولتحضير المحلول المخفف نأخذ بالماصة 5 mL من الحمض المركز ونضيفه للماء في دورق حجمي، ونكمل الحجم إلى 300 mL.
أتحقق صفحة (83):
أحسب حجم الماء اللازم إضافته إلى 50 mL من محلول KCl الذي تركيزه 4 M ليصبح تركيزه 0.2 M
تحليل السؤال (المعطيات)
M1 = 4 M
M2 = 0.2 M
V1 = 50 mL
?? V2 =
الحل:
M1 x V1 = M2 x V2
4 x 50 = 0.2 x V2
V2 = 1000 mL
حجم الماء المضاف = 1000 – 50 = 950 mL
إعداد : أ. أحمد الحسين
02 / 11 / 2024
النقاشات