العدد الذري والعدد الكتلي
Atomic Number and Mass Number
العدد الذري
تختلف ذرات كل عنصر عن غيرها في عدد البروتونات، ولا يمكن أن يتشابه عنصران في عدد البروتونات، وقد أطلق على عدد البروتونات في نواة الذرة اسم العدد الذري.
فمثلاً، يوجد في نواة عنصر الهيدروجين بروتون واحد؛ لذا يكون العدد الذري للهيدروجين (1)، ويكون عدد الإلكترونات (1) وهذا ما يجعل الذرة متعادلة.
ويوجد في نواة عنصر الهيليوم بروتونين؛ لذا يكون العدد الذري للهيليوم (2)، ويكون عدد الإلكترونات (2).
وعليه نقول في الذرة المتعادلة يكون:
العدد الذري = عدد البروتونات الموجبة = عدد الإلكترونات السالبة
العدد الكتلي
يطلق على مجموع البروتونات والنيوترونات الموجودة في الذرة العدد الكتلي.
العدد الكتلي = عدد البروتونات + عدد النيوترونات.
وقد اتفق العلماء على أن يكتب العدد الذري إلى يسار رمز العنصر من الأسفل، وأن يكتب العدد الكتلي إلى يسار رمز العنصر من الأعلى.

مثال:
العدد الذري لعنصر الألمنيوم Al = 13 والعدد الكتلي له = 27
ما عدد كل من البروتونات والإلكترونات والنيوترونات في ذرة الألمنيوم المتعادلة؟

الحل:
من العدد الذري (13) يمكن استنتاج أن:
عدد البروتونات = عدد الإلكترونات = 13
من العدد الكتلي (27) والعدد الذري (13) يمكن استخراج عدد النيوتونات على النحو التالي:
عدد النيوترونات = العدد الكتلي – العدد الذري
عدد النيوترونات = 27 - 13
= 14

النظائر
لا تعتبر النيوترونات عدداً مميزاً للعنصر، فمثلاً، لا تحتوي معظم ذرات الهيدروجين على نيوترونات، في حين يحتوي بعضها الآخر على (1) نيوترونات أو (2)، وتسمى ذرات الهيدروجين في هذه الحالة النظائر.
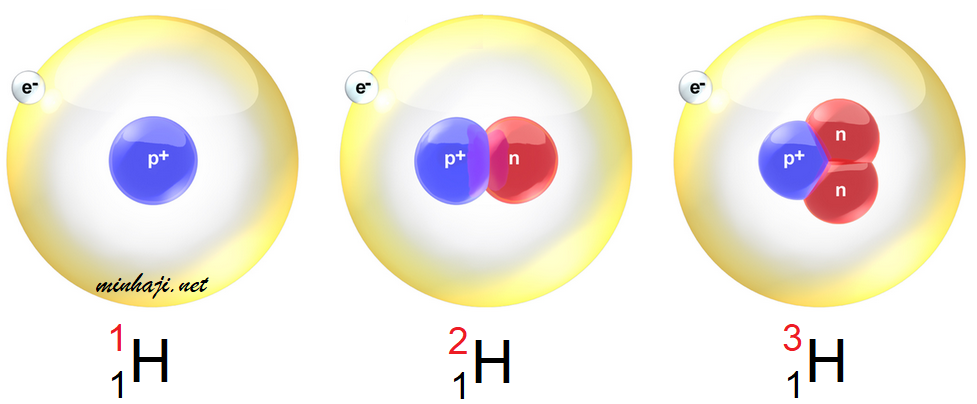
النظائر: ذرات للعنصر لها العدد الذري نفسه، لكن نواتها تحتوي على أعداد مختلفة من النيورتونات؛ أي أنها تختلف في العدد الكتلي.
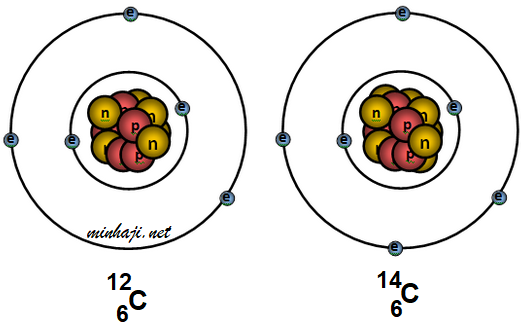
سؤال:
الشكل التالي يمثل نظيران للكربون، حدد عدد البروتونات والنيوترونات والإلكترونات في كل نظير.
إعداد : شبكة منهاجي التعليمية
29 / 08 / 2022
النقاشات