تكون الأيونات
Ions Formation
تسمى عناصر المجموعة الثامنة في الجدول الدوري بالعناصر النبيلة أو الخاملة، وسميت بذلك لأن مستوى الطاقة الخارجي (الأخير) ممتلىء بالحد الأقصى من الإلكترونات، فهي بذلك عناصر مستقرة ولا تميل للتفاعل.
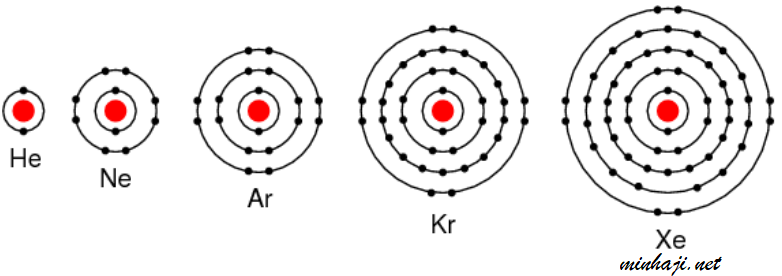
2He: 2
10Ne: 2 , 8
18Ar: 2 , 8 , 8
36Kr: 2 , 8 , 18 , 8
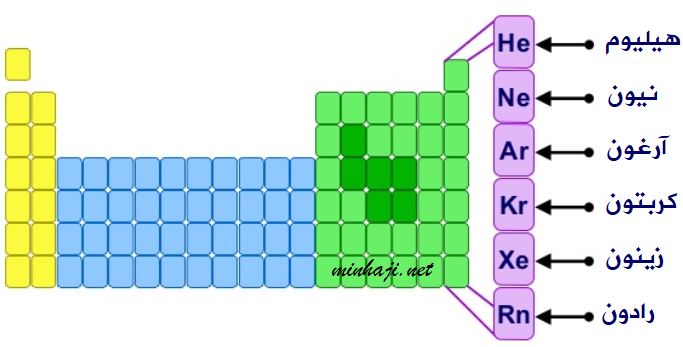
جميع الغازات النبيلة تحتوي على (8) إلكترونات في الغلاف الأخير، باستثناء الهيليوم الذي يكتمل مستوى الطاقة الأخير له بإلكترونين.
تميل الذرات للوصول إلى حالة الاستقرار بأن يصبح توزيعها الإلكتروني مشابهاً للتوزيع الإلكتروني لأقرب غاز نبيل لها، وذلك إما عن طريق فقد أو كسب الإلكترونات، أو التشارك بالإلكترونات، ويحدث ذلك من خلال التفاعلات الكيميائية، وتكوين الروابط.
مثال (1):
ماذا يحدث عند اقتراب ذرة صوديوم (العدد الذري = 11) من ذرة كلور (العدد الذري = 17)؟
لكي تصل ذرة الصوديوم إلى حالة الاستقرار فإنها تميل لفقد إلكترون ليصبح توزيع ذرتها الإلكتروني مشابهاً لغاز النيون النبيل (العدد الذري = 10) المستقر، وتصبح ذرة الصوديوم أيوناً أحادياً موجباً (Na+).
لكي تصل ذرة الكلور إلى حالة الاستقرار فإنها تميل لكسب إلكترون من ذرة الصوديوم ليصبح توزيع ذرتها الإلكتروني مشابهاً لغاز الآرغون النبيل (العدد الذري = 18) المستقر، وتصبح ذرة الكلور أيوناً أحادياً سالباً (Cl-).
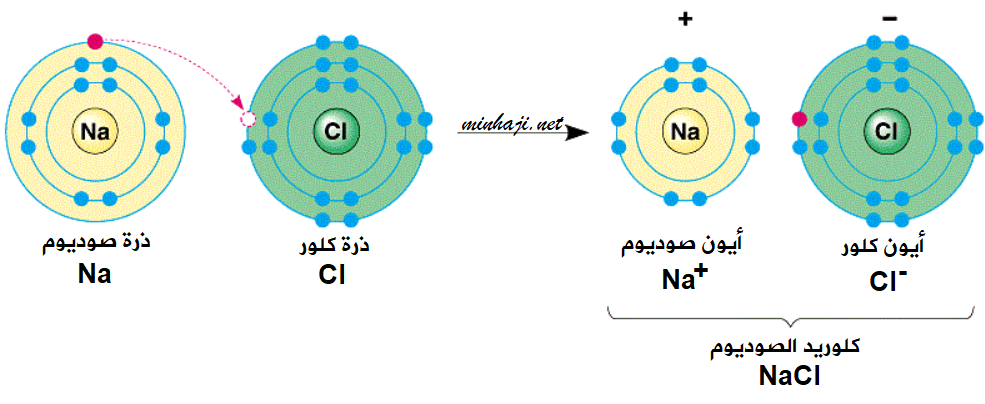
ثم يرتبط أيون الصوديوم الموجب بأيون الكلور السالب مكوناً مركباً كيميائياً هو كلوريد الصوديوم.
مثال (2):
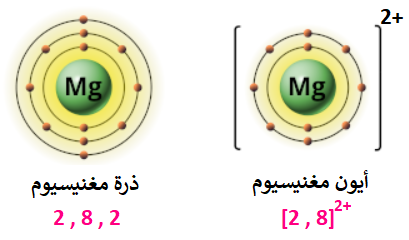
ما الأيون الذي يمكن أن تكونه ذرة المغنيسيوم (12Mg)؟
التوزيع الإلكتروني لذرة المغنيسيوم، هو:
12Mg: 2 , 8 , 2
ألاحظ من التوزيع الإلكتروني لذرة المغنيسيوم أن مستوى الطاقة الخارجي يحتوي على (2) إلكترون، وكي تصل ذرة المغنيسيوم إلى حالة الاستقرار تميل الذرة لفقد إلكتروني مستوى الطاقة الخارجي وتكوين أيون (Mg2+)، ويصبح التوزيع الإلكتروني للأيون الناتج مشابهاً لغاز النيون النبيل والمستقر.
مثال (3):
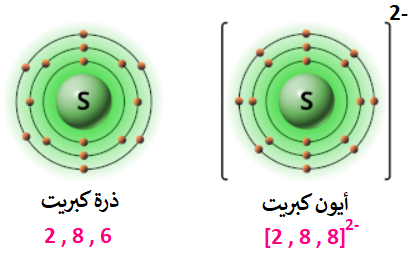
ما الأيون الذي يمكن أن تكونه ذرة الكبريت (16S)؟
التوزيع الإلكتروني لذرة الكبريت، هو:
16S: 2 , 8 , 6
ألاحظ من التوزيع الإلكتروني لذرة الكبريت أن مستوى الطاقة الخارجي يحتوي على (6) إلكترون، وكي تصل ذرة الكبريت إلى حالة الاستقرار تميل الذرة لكسب إلكترونين وتكوين أيون (S2-)، ويصبح التوزيع الإلكتروني للأيون الناتج مشابهاً لغاز الآرغون النبيل والمستقر.
سؤال:
1- أكمل الجدول الآتي:
|
رمز العنصر |
العدد الذري |
التوزيع الإلكتروني للذرة |
رمز الأيون |
التوزيع الإلكتروني للأيون |
رمز أقرب غاز نبيل |
العدد الذري للعنصر النبيل |
التوزيع الإلكتروني للعنصر النبيل |
|
Al |
13 |
|
|
2 , 8 |
|
10 |
|
|
N |
|
2 , 5 |
|
|
|
|
2 , 8 |
|
Li |
|
2 , 1 |
|
|
He |
|
|
|
F |
9 |
|
F- |
2 , 8 |
|
10 |
|
2- أكتب التوزيع الإلكتروني لكلٍّ من الأيونات الآتية:
12Mg2+: ………………………
8O2-: ……………………………
3- أوضح كيف يصل كلِّ من الألمنيوم (13Al)، والفلور (9F) لحالة الاستقرار.
الحل:
1- أكمل الجدول:
|
رمز العنصر |
العدد الذري |
التوزيع الإلكتروني للذرة |
رمز الأيون |
التوزيع الإلكتروني للأيون |
رمز أقرب غاز نبيل |
العدد الذري للعنصر النبيل |
التوزيع الإلكتروني للعنصر النبيل |
|
Al |
13 |
2 , 8 , 3 |
Al3+ |
2 , 8 |
Ne |
10 |
2 , 8 |
|
N |
7 |
2 , 5 |
N3- |
2 , 8 |
Ne |
10 |
2 , 8 |
|
Li |
3 |
2 , 1 |
Li+ |
2 |
He |
2 |
2 |
|
F |
9 |
2 , 7 |
F- |
2 , 8 |
Ne |
10 |
2 , 8 |
2- التوزيع الإلكتروني للأيونات:
12Mg2+: 2 , 8
8O2-: 2 , 8
3- يصل الألمنيوم إلى حالة الاستقرار عندما يفقد (3) إلكترونات ويكوّن الأيون Al3+ ويصبح توزيعه مشابهاً لغاز النيون النبيل (2 , 8)، ويصل الفلور إلى حالة الاستقرار عندما يكسب إلكترون ويكوّن الأيون F- ويصبح توزيعه مشابهاً لغاز النيون النبيل (2 , 8).
إعداد : شبكة منهاجي التعليمية
29 / 08 / 2022
النقاشات