تعيين رتبة التفاعل لتفاعل يشتمل على أكثر من مادة متفاعلة
مثال:
يتفاعل NO2 مع HCl في الحالة الغازية حسب المعادلة الموزونة التالية:
NO + H2O + Cl2 → NO2 + 2HCl
وقد جمعت البيانات المدونة في الجدول التالي عند درجة 25 ْ س، والتي تمثل السرعة الابتدائية عند تراكيز مختلفة من HCl , NO2 .
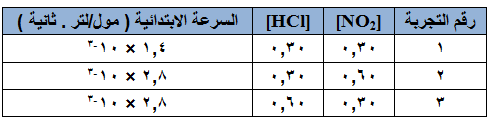
- اكتب الصيغة العامة لقانون سرعة التفاعل.
- جد رتبة التفاعل بالنسبة للمادة NO2 .
- جد رتبة التفاعل بالنسبة للمادة HCl .
- ما رتبة التفاعل الكلية؟
- اكتب قانون سرعة التفاعل.
- احسب قيمة الثابت k مبيناً وحدته.
- احسب سرعة التفاعل عندما يكون [NO2] = [HCl] = 0,1 مول/لتر .
الحل:
1. الصيغة العامة لقانون السرعة هي:
سرعة التفاعل = y[HCl] x[NO2] k
2. لإيجاد رتبة التفاعل بالنسبة للمادة NO2 نلاحظ أن [HCl] ثابتاً في التجربتين (1 ، 2) ، وأن مضاعفة [NO2] مرتين أدى إلى مضاعفة سرعة التفاعل مرتين، أي أن التفاعل بالنسبة لـ NO2 هو من الرتبة الأولى.
أو يمكن أن نقسم التجربة رقم (2) على التجربة رقم (1):
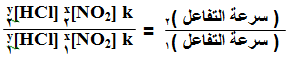
وباختصار قيمة ثابت السرعة k وتركيز HCl لأنهما ثابتان تصبح العلاقة:
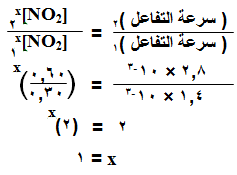
3. لإيجاد رتبة التفاعل بالنسبة للمادة HCl نلاحظ أن [NO2] ثابتاً في التجربتين (1 ، 3)، وأن مضاعفة [HCl] مرتين أدى إلى مضاعفة سرعة التفاعل مرتين، أي أن التفاعل بالنسبة لـ HCl هو من الرتبة الأولى.
أو يمكن أن نقسِم التجربة رقم (3) على التجربة رقم (1):
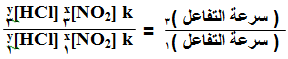
وباختصار قيمة ثابت السرعة k وتركيز NO2 لأنهما ثابتان تصبح العلاقة:

4. رتبة التفاعل الكلية تساوي مجموع (x+y) = 1 + 1 = 2 ، لذلك يوصف التفاعل بأنه من الرتبة الثانية.
5. قانون السرعة للتفاعل هو:
سرعة التفاعل = k [NO2]1[HCl] 1
6. لحساب قيمة ثابت السرعة k نعوّض قيم التركيز والسرعة في إحدى التجارب الواردة في الجدول، فمثلاً يمكن تعويض القيم الواردة في الجدول والخاصة بالتجربة رقم (1):
سرعة التفاعل = k [NO2] 1[HCl] 1

7. لحساب سرعة التفاعل نعوّض قيمة ثابت السرعة المحسوب في الفرع السابق، والتراكيز المعطاة في السؤال في قانون السرعة:
سرعة التفاعل = k [NO2] 1[HCl] 1
سرعة التفاعل = 0,015 × (0,1)1 × (0,1)1 = 0,00015 مول/لتر.ث
سؤال 1 :
في التفاعل الافتراضي الآتي: 3C + 2D → 2A + 3B، تم جمع البيانات العملية كما هو مبين في الجدول أدناه. اعتماداً على البيانات الواردة في الجدول، أجب عما يأتي:
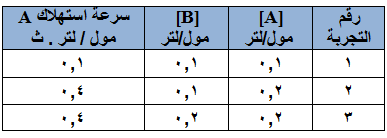
- احسب رتبة التفاعل لكل من المادتين: A ، B .
- اكتب قانون سرعة التفاعل.
- احسب قيمة ثابت سرعة التفاعل (k) مع ذكر وحدته.
سؤال 2 :
في التفاعل الآتي 2NO2 → 2NO + O2 ، تم جمع البيانات العملية كما هو مبين في الجدول أدناه، اعتماداً على البيانات الواردة في الجدول، أجب عما يأتي:
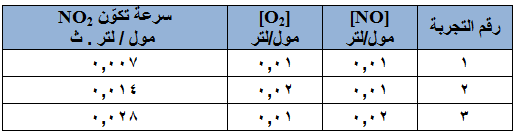
- احسب رتبة التفاعل لكل من المادتين : O2 ، NO .
- اكتب قانون سرعة التفاعل ثم احسب قيمة ثابت سرعة التفاعل (k) مع ذكر وحدته.
سؤال 3 :
في التفاعل الافتراضي الآتي:2C → 2A + B
تم جمع البيانات العملية كما هو مبين في الجدول التالي:
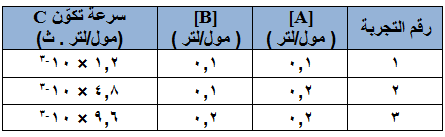
اعتماداً على البيانات الواردة، أجب عما يأتي:
- احسب رتبة التفاعل بالنسبة إلى المادة A ، والمادة B .
- اكتب قانون السرعة لهذا التفاعل.
- احسب قيمة ثابت سرعة التفاعل (k) ، مع ذكر وحدته.
سؤال 4 :
اعتماداً على البيانات الواردة في الجدول الآتي للتفاعل : C (g) + 2D (g) → 2A (g) + 2B (g)
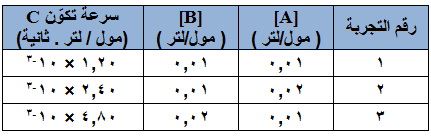
- احسب رتبة التفاعل بالنسبة إلى المادة A .
- احسب رتبة التفاعل بالنسبة إلى المادة B .
- اكتب قانون السرعة للتفاعل السابق.
- احسب قيمة ثابت سرعة التفاعل السابق (k ) مع ذكر وحدته.
سؤال 5 :
في التفاعل الآتي: 2NOCl → 2NO + Cl2 ، تم جمع البيانات العملية كما هو مبين في الجدول أدناه، أجب عما يأتي:
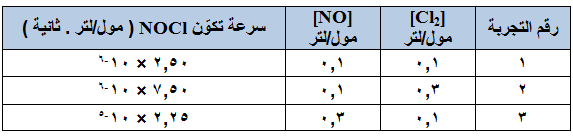
- احسب رتبة التفاعل لكل من المادتين: Cl2 ، NO .
- اكتب قانون سرعة التفاعل.
- احسب قيمة ثابت السرعة (k) مع ذكر وحدته.
سؤال 6 :
في التفاعل الافتراضي الآتي:
نواتج → F + E + D
تم تسجيل البيانات المبينة في الجدول أدناه عملياً من خلال التجربة:
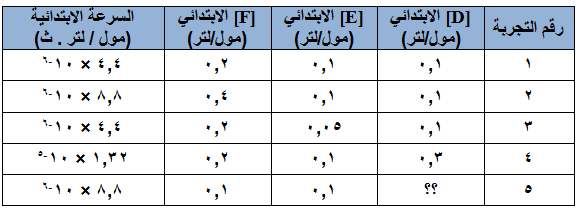
- اكتب قانون سرعة التفاعل.
- احسب تركيز المادة D في التجربة رقم (5).
سؤال 7 :
يتفاعل الماء مع CH3Cl حسب المعادلة التالية:
CH3OH + HCl → CH3Cl + H2O
إذا علمت أن سرعة التفاعل تتضاعف مرتين عند مضاعفة تركيز CH3Cl مرتين، كما تتضاعف السرعة أربع مرات عند مضاعفة تركيز H2O مرتين.
أجب عما يأتي:
- احسب رتبة التفاعل بالنسبة لكل من المادتين H2O , CH3Cl .
- اكتب قانون سرعة التفاعل.
- إذا كانت سرعة التفاعل = 1,5 مول / لتر.ثانية، عندما يكون [H2O] = [CH3Cl] = 0,2 مول/لتر. احسب قيمة ثابت سرعة التفاعل (k).
سؤال 8 :
أ) ادرس الجدول المجاور الذي يوضح بيانات التفاعل الافتراضي: 2C + 2D → 3A + B ثم أجب عن الأسئلة الآتية:
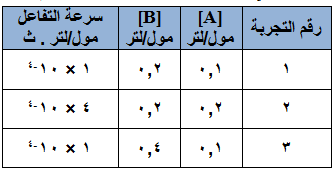
- ما رتبة التفاعل بالنسبة إلى المادة A ؟
- ما رتبة التفاعل بالنسبة إلى المادة B ؟
- اكتب قانون السرعة لهذا التفاعل.
- ما قيمة ثابت سرعة التفاعلk ؟
ب) إذا كانت رتبة التفاعل لمادة متفاعلة هي (1) وازداد تركيز المادة إلى الضعف مع بقاء العوامل الأخرى ثابتة، فكم مرة تتضاعف سرعة التفاعل؟
سؤال 9 :
اعتماداً على البيانات الواردة في الجدول الآتي للتفاعل: C → A + B
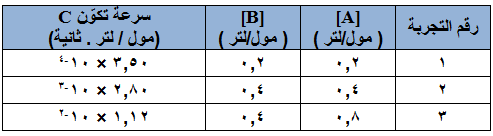
- احسب رتبة التفاعل بالنسبة إلى المادة A ، وإلى المادة B .
- احسب قيمة ثابت سرعة التفاعل السابق (k) مع ذكر وحدته.
سؤال 10 :
في التفاعل العام الآتي : 2C + D → 2A + 2B ، وكان قانون سرعة التفاعل (س) = [B] [A] k 2 ، فكم تتضاعف سرعة التفاعل في الحالات التالية:
- عند مضاعفة تركيز كل من A ، B معاً.
- مضاعفة تركيز B مرتين ومضاعفة تركيز A ثلاث مرات.
سؤال 11 :
إذا كان قانون سرعة للتفاعل: G → M + R هو: السرعة = [R] k 2
وكانت سرعة التفاعل 1,2 × 10-3 مول/لتر.ث، فكم تصبح قيمة سرعة التفاعل في الحالات التالية:
- مضاعفة تركيز R ثلاث مرات، و M مرتين.
- تقليل تركيز R إلى النصف، ومضاعفة تركيز M أربع مرات.
سؤال 12 :
في التفاعل الغازي: 2NOCl → 2NO + Cl2 ، وجد أن سرعة التفاعل تتضاعف مرتين عند مضاعفة [Cl2] مرتين مع بقاء [NO] ثابتاً، كما تتضاعف سرعة التفاعل (8) مرات عند مضاعفة تركيز كل من Cl2، NO مرتين.
- ما رتبة التفاعل بالنسبة للمادتين Cl2 و NO ؟
- اكتب قانون سرعة التفاعل.
سؤال 13 :
التفاعل التالي يحدث في الهواء الملوث: N2O5 + O2 → 2NO2 + O3
فإذا كان قانون السرعة لهذا التفاعل هو: س = [O3] [NO2] k ، وجمعت البيانات التالية لهذا التفاعل، فجد قيمتي (س)، (ص).
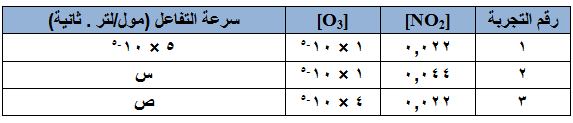
سؤال 14 :
الرتبة الكلية للتفاعل الغازي التالي:
نواتج → 2AB + 2C هو (3)، وقد تم الحصول على النتائج المبينة في الجدول أدناه.
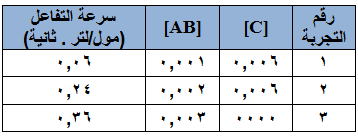
احسب [C] في التجربة الثالثة.
سؤال 15 :
في التفاعل الافتراضي التالي: 2C + 2D → A + 3B ، تم جمع البيانات العملية كما هو مبين في الجدول أدناه. اعتماداً على البيانات الواردة في الجدول، أجب عن الأسئلة التي تلي الجدول، علماً بأن قيمة ثابت السرعة للتفاعل تساوي 10 لتر/مول . ث:
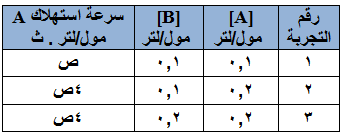
- احسب رتبة التفاعل لكل من المادتين: A ، B .
- اكتب قانون سرعة التفاعل.
- احسب قيمة (ص).
إعداد : أ. أحمد الحسين
16 / 02 / 2019
النقاشات