مفهوم برونستد – لوري
Bronsted - Lowry Concept
الحمض: مادة يمكنها منح بروتون واحد أو أكثر في أثناء التفاعل (مانح للبروتون).
القاعدة: مادة يمكنها استقبال بروتون واحد أو أكثر في أثناء التفاعل (مستقبل للبروتون).

يُفسر برونستد - لوري السلوك الحمضي للحموض التي فسرها أرهينيوس باعتبار أن الحمض مانح للبروتون بينما يمثل الماء القاعدة؛ لأنه استقبل البروتون كما في المعادلة:
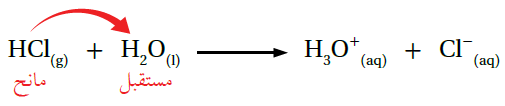
لاحظ أن الماء وضع في معادلة برونستد - لوري كمادة متفاعلة، وليس على السهم كمعادلة أرهينيوس، وأن الحمض عندما منح بروتون قلت شحنته بمقدار واحد، ولاحظ أن مجموع الشحنات في طرفي المعادلة متساوٍ.
ويفسر برونستد - لوري السلوك القاعدي للأمونيا باعتبارها مستقبلة للبروتون، بينما يمثل الماء الحمض؛ لأنه مانح للبروتون كما في المعادلة:
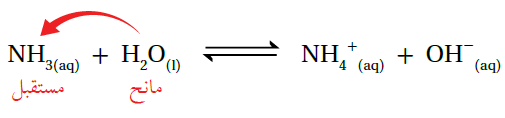
لاحظ أن القاعدة عندما استقبلت بروتون زادت شحنتها بمقدار واحد، ولاحظ أن مجموع الشحنات على الطرفين متساوٍ.
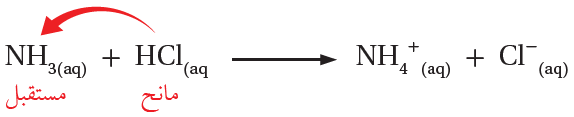
وعند خلط حمض الهيدروكلوريك مع الأمونيا ينتقل البروتون من الحمض (HCl) إلى القاعدة (NH3)، كما في المعادلة:
سؤال 1 :
أحدد الحمض والقاعدة في التفاعلين الآتيين:
N2H4(aq) + H2O(l) N2H5+(aq) + OH-(aq)
HCOOH(aq) + H2O(l) HCOO-(aq) + H3O+(aq)
سؤال 2 :
فسّر مستعيناً بمعادلات سلوك كلّ من المواد التالية وفق مفهوم برونستد - لوري:
1- السلوك الحمضي لمحلول حمض النيتريك HNO3 .
2- السلوك الحمضي لمحلول حمض البنزويك C6H5COOH .
3- السلوك القاعدي لمحلول ميثيل أمين CH3NH2 .
4- سلوك CN- في الماء.
5- سلوك NH4+ في الماء.
6- تفاعل إيثيل أمين C2H5NH2 مع حمض الهيدروبروميك HBr .
أوجه القصور في تعريف برونستد - لوري:
- لم يوضح التعريف كيفية ارتباط البروتون بالقاعدة.
- العديد من التفاعلات لا تشتمل على انتقال للبروتون، مثل CO2 مع الماء، وتفاعل الأيونات الفلزية مع الماء أو الأمونيا وغيرها (أي لم يفسر سلوك الحموض التي لا تحتوي على هيدروجين).
في الملفات المرفقة أسئلة موضوعية على مفهوم برونستد - لوري مع إجاباتها.
في الملفات المرفقة إجابات أسئلة درس مفهوم برونستد - لوري.
إعداد : أ. أحمد الحسين
14 / 08 / 2024
النقاشات