قانون بويل
Boyle’s Law
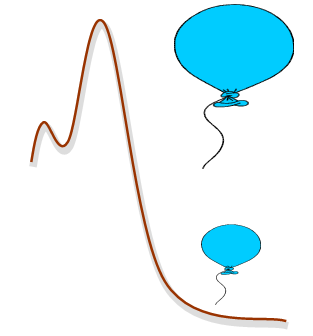 لماذا يتمدد البالون ويزداد حجمه بعد أن يصل إلى ارتفاعات عالية؟
لماذا يتمدد البالون ويزداد حجمه بعد أن يصل إلى ارتفاعات عالية؟
هل لذلك علاقة بالضغط؟
يتمدد الهواء داخل البالون بعد صعوده للأعلى بسبب نقصان الضغط الجوي، فكلما ارتفعنا للأعلى يقل الضغط الجوي ويزداد حجم الهواء داخل البالون فيتمدد.
الكيميائي البريطاني روبرت بويل كان أول من تحقق من العلاقة بين حجم الغاز والضغط المسلط عليه، ووضع قانوناً عًرف باسمه.
نص قانون بويل:
"حجم كمية محددة من الغاز المحصور يتناسب عكسياً مع الضغط الواقع عليه عند ثبات درجة حرارته".
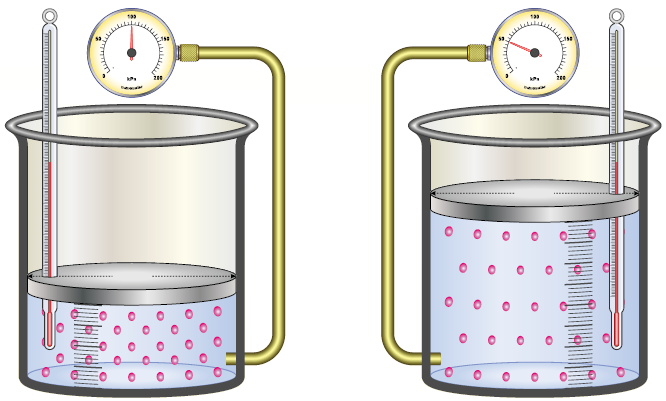
تفسير قانون بويل استناداً إلى افتراضات نظرية الحركة الجزيئية:
عند تقليل حجم الغاز تقل المسافة بين جدران الوعاء، وبما أن متوسط سرعة الجزيئات ثابت عند ثبات درجة الحرارة، فإن عدد التصادمات بين دقائق الغاز والجدران تزداد، فيزاد ضغط الغاز.
اشتقاق القانون:
يُعبّر عن قانون بويل رياضيّاً على النحو الآتي:
عند ثبات درجة الحرارة (T) فإن ضغط الغاز (P) يتناسب عكسياً مع حجمه (V):
P
وبتحويل إشارة التناسب إلى إشارة مساواة نضرب في ثابت (k):
P = k
وبترتيب حدود العلاقة:
k = P x V
فلو كان لدينا ظرفان مختلفان للغاز، يكون:
k = P1 x V1
k = P2 x V2
وبمساواة الحدين، نحصل على قانون بويل:
P1 x V1 = P2 x V2
وعند تطبيق قانون بويل يجب تجانس وحدات الضغط والحجم.

أمثلة محلولة
مثال (1):
تشغل كتلة من غاز الأكسجين حجماً قدره 40mL عند 1 atm، احسب حجمه عند ضغط 0.8 atm ، بفرض بقاء درجة حرارته ثابتة.
تحليل السؤال (المعطيات)
P1 = 1 atm
P2 = 0.8 atm
V1 = 40 mL
V2 = ??
الحل:
P1 V1 = P2 V2
1 x 40 = 0.8 x V2
V2 = 50 mL
مثال (2):
عينة من غاز ضغطها 3 atm. فإذا قل حجمها بمقدار النصف، فكم يصبح ضغطها بفرض بقاء درجة الحرارة ثابتة.
تحليل السؤال (المعطيات)
معنى أن يقل الحجم إلى النصف أنّ: V2 = 0.5 V1
P1 = 3 atm
P2 = ??
V1 = V1
V2 = 0.5 V1
الحل:
P1 V1 = P2 V2
3 x V1 = P2 x 0.5 V1
3 = P2 x 0.5
P2 = 6 atm
مثال (3):
علبة بخاخ تحتوي على 400 mL من الغاز تحت ضغط 5 atm، عند تفريغ الغاز الموجود داخل العلبة في كيس بلاستيكي، انتفخ الكيس إلى حجم 2 L. ما ضغط الغاز داخل الكيس البلاستيكي بافتراض بقاء درجة الحرارة ثابتة.
تحليل السؤال (المعطيات)
قبل حل السؤال يجب أن تكون وحدات الحجم متجانسة.
P1 = 5 atm
P2 = ??
V1 = 400 mL = 0.4 L
V2 = 2 L
الحل:
P1 V1 = P2 V2
5 x 0.4 = P2 x 2
P2 = 1 atm
أتحقق صفحة (59):
عينة من غاز محصور حجمها 4 L عند ضغط 2 atm ، سُمح لها بالتمدد حتى أصبح حجمها 12 L. احسب ضغطها عند درجة الحرارة نفسها.
تحليل السؤال (المعطيات)
قبل حل السؤال يجب أن تكون وحدات الحجم متجانسة.
P1 = 2 atm
P2 = ??
V1 = 4 L
V2 = 12 L
الحل:
P1 V1 = P2 V2
2 x 4 = P2 x 12
P2 = 0.66 atm
سؤال:
عينة من غاز ثاني أكسيد الكبريت SO2 حجمها 1.53 Lعند ضغط 5.6 atm. إذا تغير الضغط إلى 1.5 atm، فكم يصبح حجم الغاز عند درجة الحرارة نفسها؟
الإجابة: 5.71 L
إعداد : أ. أحمد الحسين
02 / 11 / 2022
النقاشات
Eman daboubi
تمام
إضافة رد
0 ردود