قانون جراهام للانتشار والتدفق
Graham’s Law of Diffusion an Effusion
مفهوم الانتشار والتدفق
الانتشار: حركة الجسيمات من المنطقة الأعلى تركيزاً إلى المنطقة الأقل تركيزاً.
مثال: انتشار رائحة العطور في أرجاء المنزل عند رشّها.
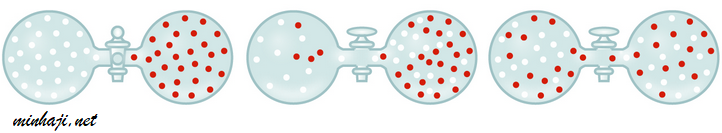
التدفق: تسرب الغاز المضغوط من فتحة صغيرة.
مثال: تسرب الهواء من عجل السيارة نتيجة اختراقه بواسطة مسمار.
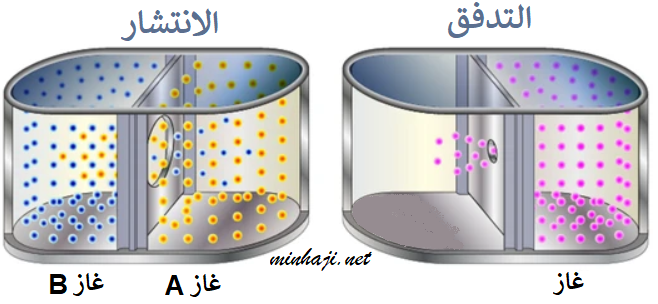
درس العالم جراهام انتشار الغازات وتدفقها، فلاحظ أن الغازات ذات الكتل المولية الأقل أسرع انتشاراً (تدفقاً) من الغازات ذات الكتل المولية الأكبر.
قانون جراهام
قانون جراهام: معدل سرعة انتشار (تدفق) الغاز يتناسب عكسياً مع الجذر التربيعي لكتلته المولية.
النص الرياضي لقانون غراهام

تفسير قانون جراهام استناداً إلى افتراضات نظرية الحركة الجزيئية:
يحدث الانتشار لأن جزيئات الغاز متباعدة وفي حركة مستمرة وسريعة وعشوائية؛ مما يسمح لها بالاختلاط بغيرها.
مثال:
احسب النسبة بين سرعة تدفق غاز الهيليوم (He) إلى غاز النيتروجين (N2) ، عند الظروف نفسها.
تحليل السؤال (المعطيات)
MrHe = 4 g/mol
MrN2 = 28 g/mol

أتحقق صفحة (76):
ما نسبة سرعة انتشار غاز الهيدروجين (H2) إلى سرعة انتشار غاز ثاني أكسيد الكربون (CO2) عند الظروف نفسها.
تحليل السؤال (المعطيات)
MrH2 = 2 g/mol
MrCO2 = 44 g/mol
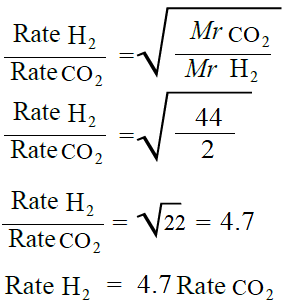
إعداد : أ. أحمد الحسين
06 / 11 / 2021
النقاشات