طاقة التأين
Ionization energy
طاقة التأين بشكل عام تمثل الطاقة التي تعطى للذرة أو الأيون الموجب لنزع الإلكترون الأخير.
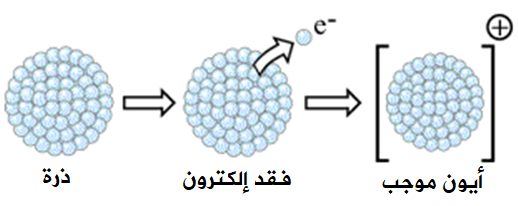
وبشكل عام تعرف طاقة التأين على النحو التالي:
طاقة التأين: الحد الأدنى من الطاقة الضرورية لفصل الإلكترون الأضعف ارتباطاً بنواة الذرة في الحالة الغازية فصلاً نهائياً.
ولكل عنصر عدد من طاقات التأين تساوي عدده الذري، فعنصر الصوديوم مثلاً يمتلك (11) طاقة تأين لأن عدده الذري = 11 .
طاقة التأين الأول: الحد الأدنى من الطاقة اللازمة لفصل الإلكترون الأضعف ارتباطاً بنواة ذرة العنصر المتعادلة وهي في الحالة الغازية.
المعادلة الآتية تمثل معادلة طاقة التأين الأول (ط1) للصوديوم:
Na (g) + 495.8 kj/mol → Na+ (g) + e
طاقة التأين الثاني: الحد الأدنى من الطاقة اللازمة لفصل الإلكترون الأضعف ارتباطاً بنواة أيون العنصر الأحادي الموجب وهو في الحالة الغازية.
المعادلة الآتية تمثل معادلة طاقة التأين الثاني (ط2) للصوديوم:
Na+ (g) + 4565 kj/mol → Na2+ (g) + e
سؤال:
اكتب المعادلة التي تمثل طاقة التأين الثالث لعنصر الصوديوم، علماً بأن : ط3 = 6912 كيلوجول/مول.
الإجابة:
Na2+ (g) + 6912 kj/mol → Na3+ (g) + e
ملاحظة:
- لأي عنصر دائماً:
ط1 > ط2 > ط3 > ط4 ......
لأنه كلما نزعنا إلكترون من الذرة أو الأيون قل الحجم وزادت طاقة التأين.
سؤال:
ماذا تمثل قيم الطاقة التي تحتها خط في المعادلات التالية:
Al3+ (g) + 11580 kj/mol → Na4+ (g) + e
P+ (g) + 1896 kj/mol → P2+ (g) + e
S5+ (g) + 8490 kj/mol → S6+ (g) + e
الإجابة:
- المعادلة الأولى: طاقة التأين الرابع للألمنيوم.
- المعادلة الثانية: طاقة التأين الثاني للفسفور.
- المعادلة الثالثة: طاقة التأين السادس للكبريت.
دورية طاقة التأين
لاحظ كيف تتغير قيم طاقات التأين للعناصر في الجدول الدوري:
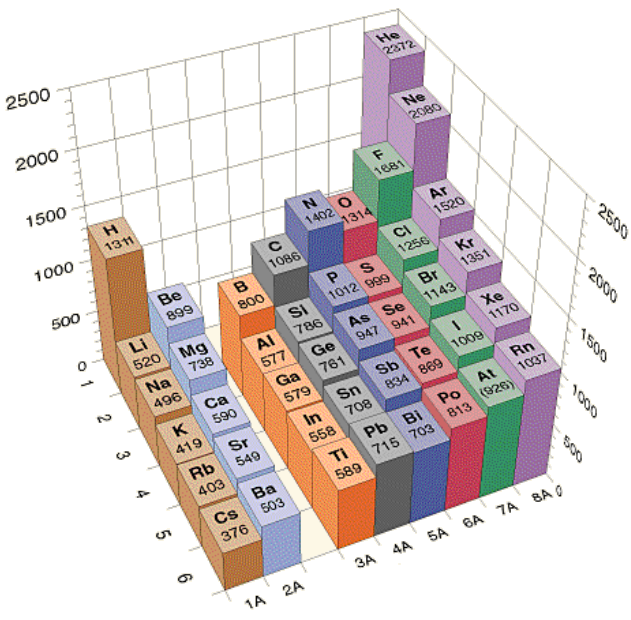
لاحظ أنها عكس التغير في الحجم.
إعداد : شبكة منهاجي التعليمية
18 / 10 / 2020
النقاشات