إجابات أسئلة مراجعة الوحدة الثانية
التوزيع الإلكتروني والدورية
السؤال الأول:
أوضح المقصود بالمفاهيم والمصطلحات الآتية:
شحنة النواة الفعالة، الحجم الأيوني، طاقة التأين الثانية.
شحنة النواة الفعالة: القدرة الفعلية للبروتونات الموجبة في النواة على جذب إلكترونات المستوى الخارجي (إلكترونات التكافؤ) نحوها، بعد تأثير الإلكترونات الحاجبة.
الحجم الأيوني: حجم الأيون الناتج من زيادة عدد الإلكترونات أو نقصانها.
طاقة التأين الثانية: الطاقة اللازمة لنزع الإلكترون من الأيون الأحادي الموجب في الحالة الغازية.
السؤال الثاني:
أكتب التوزيع الإلكتروني لكل عنصر من العناصر الآتية: S ،Mn ،Ge ،Cu بدلالة العنصر النبيل المناسب لكل منها، ثم أجيب عمّا يأتي:
Cu: [Ar] 4s1 3d10
Ge: [Ar] 4s2 3d10 4p2
Mn: [Ar] 4s2 3d5
S: [Ne] 3s2 3p4
أ- ما رقم الدورة ورقم المجموعة لكل عنصر من هذه العناصر؟
Cu: الدورة الرابعة، المجموعة 1B .
Ge: الدورة الرابعة، المجموعة 4A .
Mn: الدورة الرابعة، المجموعة 7B .
S: الدورة الثالثة، المجموعة 6A .
ب- ما عدد الإلكترونات المنفردة في ذرة كلّ منها؟
Cu : (إلكترون)، Ge : (إلكترونان)، Mn : (5 إلكترونات)، S : (إلكترونان).
ج- ما عدد إلكترونات التكافؤ في ذرة العنصر S؟
(6) إلكترونات.
د- ما أكبر عدد من الإلكترونات التي لها اتجاه الغزل نفسه في المستوى الخارجي لذرة Ge؟
(3) إلكترونات (إلكترون في 4s، وإلكترونان في 4p).
هـ- ما أكبر عدد من الإلكترونات التي لها اتجاه الغزل نفسه في ذرة S؟
(9) إلكترونات.
و- أكتب التوزيع الإلكتروني لكل من: S2- ، و Mn4+.
S2-: [Ar]
Mn4+: [Ar] 3d3
السؤال الثالث:
أكتب التوزيع الإلكتروني لعنصر:
أ- من الدورة الثالثة، والمجموعة الرابعة عشرة.
1s2 2s2 2p6 3s2 3p2
ب- من الدورة الرابعة، والمجموعة السادسة B.
1s2 2s2 2p6 3s2 3p6 4s1 3d5
ج- ينتهي توزيعه الإلكتروني بالمستوى الفرعي 4p2.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2
د- ينتهي التوزيع الإلكتروني لأيونه الثنائي السالب بالمستوى الفرعي 3p6.
1s2 2s2 2p6 3s2 3p4
هـ- ينتهي التوزيع الإلكتروني لأيونه الثلاثي الموجب بالمستوى الفرعي 3d2.
1s2 2s2 2p6 3s2 3p6 4s2 3d3
السؤال الرابع:
أحدد أكبر ذرة حجماً في كل زوجٍ من الأزواج الآتية: (Mg, Na) ، (Si, C) ، (F, Cl).
(Na) ، (Si) ، (Cl).
السؤال الخامس:
أحدد الأصغر حجماً في كل من الأزواج الآتية: (Ca, Ca2+) ، (S, S2-) ، (O2-, Mg2+).
(Ca2+) ، (S) ، (Mg2+).
السؤال السادس:
أي الذرات تملك أعلى طاقة تأين أولى في الأزواج الآتية: (Na, K) ، (N, Be) ، (He, Ne).
(Na) ، (N) ، (He).
السؤال السابع:
أفسّر:
أ- تتناقص حجوم الذرات في الدورة الثالثة بالاتجاه من اليسار إلى اليمين في الجدول الدوري.
بسبب زيادة شحنة النواة الفعالة في الدورة الواحدة بالانتقال من اليسار إلى اليمين.
ب- تتناقص طاقة تأين عناصر المجموعة الواحدة بالاتجاه من الأعلى إلى الأسفل في الجدول الدوري.
بسبب زيادة الحجم الذري لعناصر المجموعة الواحدة بالانتقال من الأعلى إلى الأسفل.
ج- تزداد حجوم الأيونات السالبة مقارنة بحجوم ذراتها.
بسبب زيادة التنافر بين إلكترونات المستوى الخارجي الناتجة من كسب الإلكترونات.
السؤال الثامن:
أدرس الجدول الآتي، ثم أجيب عن الأسئلة التي تليه:

أ- أكتب التوزيع الإلكتروني لكل ذرةٍ من ذرات العناصر الآتية: Z, Y, M.
Z: [Ar] 4s1 3d5
Y: [Ne] 3s2
M: [He] 2s2 2p3
ب- ما رقم مجموعة كل عنصر من العناصر الآتية: U, X, V.
V: IA
X: 17
U: IVB
ج- ما العدد الذري لعنصر من دورة العنصر V، ومجموعة العنصر E؟
العدد الذري: 31
د- ما عدد الإلكترونات المنفردة في المستوى الخارجي لذرة العنصر R؟
(3) إلكترونات منفردة.
هـ- ما عدد إلكترونات التكافؤ في ذرة كل عنصر من العناصر الآتية: X, Y, E؟
X : (7) ، Y (2) ، E (3).
و- أي العناصر الآتية حجمه الذري أكبر: E أم R أم V؟
V
ز- أي العناصر الآتية طاقة تأينه الثالثة أعلى: M أم Y أم R؟
Y
ح- أي العناصر الآتية له أقل سالبية كهربائية: E أم X أم M؟
E
السؤال التاسع:
أكتب التوزيع الإلكتروني للعناصر الآتية، ثم أجيب عن الأسئلة التي تليها:
23V , 17Cl , 12Mg , 11Na , 10Ne , 8O , 7N
N: [He] 2s2 2p3
O: [He] 2s2 2p4
Ne: [He] 2s2 2p6
Na: [Ne] 3s1
Mg: [Ne] 3s2
Cl: [Ne] 3s2 3p5
V: [Ar] 4s2 3d3
أ- ما عدد الإلكترونات المنفردة في كل عنصر من العناصر الآتية: Mg, Cl, N.
N: (3) ، Cl: (1) ، Mg: (0).
ب- أكتب التوزيع الإلكتروني للأيون V2+.
V3+: [Ar] 3d3
ج- أي العنصرين طاقة تأينه أقل: Mg أم Na؟
Na
د- أي العنصرين حجمه الذري أكبر: O أم Cl؟
Cl
هـ- أي هذه العناصر له أعلى طاقة تأين ثانية؟
Na
و- أي هذه العناصر له أعلى سالبية كهربائية؟
O
السؤال العاشر:
العنصر X هو من عناصر الدورة الثانية، وقيم طاقة التأين له بوحدة (kJ):
ط1 = 900، ط2 = 1757، ط3 = 14850، ط4 = 21007
أ- أحدد رقم مجموعة العنصر X.
IIA
ب- أكتب التوزيع الإلكتروني للأيون X 2+.
X2+: 1s2
السؤال الحادي عشر:
أدرس في ما يأتي العناصر الافتراضية المتتالية في عددها الذري بالجدول الدوري، ثم أجيب عن الأسئلة التي تليها:
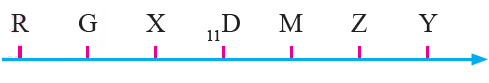
أ- أكتب التوزيع الإلكتروني لذرة العنصر X .
X: [He] 2s2 2p6
ب- ما مجموعة كل عنصر من العناصر الآتية: R, D, Y؟
Y: 14
D: 1
R: 16
ج- أي هذه العناصر له أعلى طاقة تأين ثالثة؟
M
د- أي هذه العناصر له أقل طاقة تأين؟
D
هـ- أي هذه العناصر أعلى سالبية كهربائية؟
G
و- أعمل رسماً بيانياً يمثل تغير طاقة التأين لهذه العناصر بزيادة العدد الذري.

السؤال الثاني عشر:
تُستخدم مركبات الباريوم ومركبات اليود بوصفها مواد تباين (مظللة) في التصوير بالأشعة السينية الملونة لبعض الأعضاء الداخلية والأوعية الدموية في الجسم، فهي تكسبها لوناً مميزاً؛ ما يجعل تصويرها واضحاً. أكتب التوزيع الإلكتروني لكل من الباريوم (Ba) واليود (I)، ثم أحدد موقع كل منهما (رقم الدورة، ورقم المجموعة) في الجدول الدوري.
Ba: [Xe] 6s2 ، الدورة السادسة، المجموعة 2 .
I: [Kr] 5s2 4d10 5p5 ، الدورة الخامسة، المجموعة 17 .
السؤال الثالث عشر:
أضع دائرة حول رمز الإجابة الصحيحة لكل جملةٍ ممّا يأتي:
1- المستوى الفرعي الذي يملأ أولاً بالإلكترونات هو:
أ- 4d .
ب- 4p .
ج- 5p .
د- 5s .
2- عدد البروتونات في الذرة التي تركيبها الإلكتروني [Ne] 3s2 3p4 هو:
أ- (6) بروتوناتٍ.
ب- (8) بروتوناتٍ.
ج- (16) بروتوناً.
د- (24) بروتوناً.
3- يُعد العنصر انتقالياً داخلياً إذا انتهى توزيعه الإلكتروني بأفلاك المستوى الفرعي.
أ- s .
ب- p .
ج- d .
د- f .
4- عدد إلكترونات التكافؤ لذرة تركيبها الإلكتروني 1s2 2s2 2p6 3s2 3p4 هو:
أ- إلكترونان.
ب- (4) إلكتروناتٍ.
ج- (6) إلكتروناتٍ.
د- (16) إلكتروناً.
5- أصغر ذرة حجماً من الذرات الآتية، هي:
أ- 14Si .
ب- 16S .
ج- 20Ca .
د- 32Ge .
6- الذرة التي لها أعلى طاقة تأين ثالثة من الذرات الآتية، هي:
أ- 17Cl .
ب- 13Al .
ج- 19K .
د- 20Ca .
7- المعادلة التي تمثل طاقة التأين الرابعة للمغنيسيوم، هي:
أ- Mg(g) → Mg4+(s) + 4e
ب- Mg3+(g) → Mg4+(g) + e
ج- Mg2+(g) → Mg3+(g) + e
د- Mg4+(g) → Mg5+(g) + e
8- تشير الطاقة في المعادلة:
O(g) + e → O-(g) + 141 KJ/mol
أ- طاقة التأين للأكسجين.
ب- الكهروسلبية للأكسجين.
ج- الألفة الإلكترونية للأكسجين.
د- طاقة التأين الثانية للأكسجين.
9- في الدورة الواحدة في الجدول الدوري، أي من الخصائص الآتية تزداد بزيادة العدد الذري؟
أ- نصف القطر الذري.
ب- شحنة النواة الفعالة.
ج- الحجم الذري.
د- حجم الأيون الموجب.
10- الأيون الذي له أصغر حجم هو:
أ- 11Na+
ب- 13Al3+
ج- 16S2-
د- 15P3-
إعداد : شبكة منهاجي التعليمية
18 / 12 / 2025
النقاشات