التهجين في الأمونيا والماء
التهجين في الأمونيا NH3
انظر إلى التوزيع الإلكتروني للنيتروجين:
7N: [He] 2s2 2p3
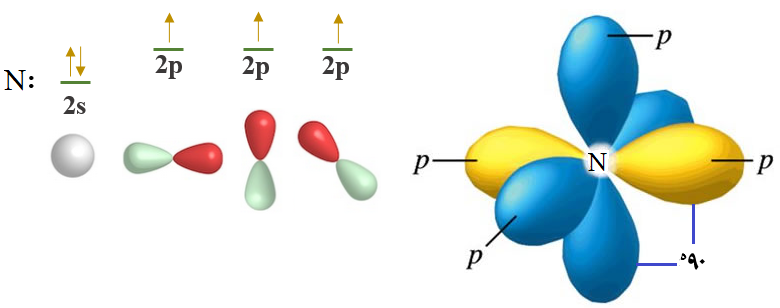
ومن التوزيع الإلكتروني تلاحظ احتواء ذرة النيتروجين على ثلاثة إلكترونات منفردة، وهذا يعني أن عدد الروابط التي يكونها النيتروجين فعلياً تطابق عدد الروابط بناءً على عدد الإلكترونات المنفردة.
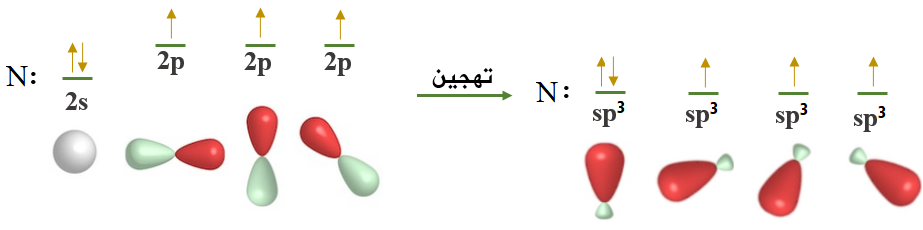
إلا أن تمثيل جزيء الأمونيا حسب تداخل الأفلاك البسيطة يتبين أن الزاوية بين الروابط تساوي 90o، لأن الزاوية بين أفلاك 2p تساوي 90o، وهذا لا يتفق مع الواقع؛ إذ إن الزاوية بين الروابط في جزيء الأمونيا فعلياً هي 107o ، وهي قريبة من الزاوية 109.5o في تهجين sp3 ، لذا تم اقتراح تهجين sp3 لذرة النيتروجين.
تساوي ذرة النيتروجين طاقة فلك 2s مع طاقة أفلاك المستوى الفرعي 2p ، وتعمل على خلط تلك الأفلاك لتكوين أربعة أفلاك مهجنة، كل واحدٍ منها يسمى sp3 ، إلا أن أحد الأفلاك المهجنة يحتوي على زوج غير رابط من الإلكترونات، وهذا الزوج من الإلكترونات يتنافر مع أزواج الإلكترونات الرابطة فيقلل قيمة الزاوية من 109.5oإلى 107o .
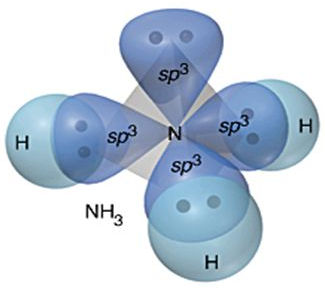
تتجه الأفلاك المهجنة في الفراغ بحيث يكون التنافر بين إلكتروناتها أقل ما يمكن وتأخذ الأفلاك شكل هرم ثلاثي، والزاوية 107o .
ثم تقدّم كل ذرة هيدروجين فلكاً ذرياً من نوع 1s .
- نوع التهجين الذي تجريه ذرة النيتروجين: sp3
- عدد الأفلاك المهجنة في ذرة النيتروجين: 4
- الشكل الهندسي (البنائي) للجزيء: هرم ثلاثي.
- قيمة الزاوية بين الأفلاك المهجنة: 107o .
- نوع الأفلاك الداخلة في تكوين الرابطة sp3-s : N-H .
- مبررات التهجين: تفسير الزاوية بين الأفلاك المهجنة.
التهجين في الماء H2O
انظر إلى التوزيع الإلكتروني للأكسجين:
8O :[He] 2s2 2p4
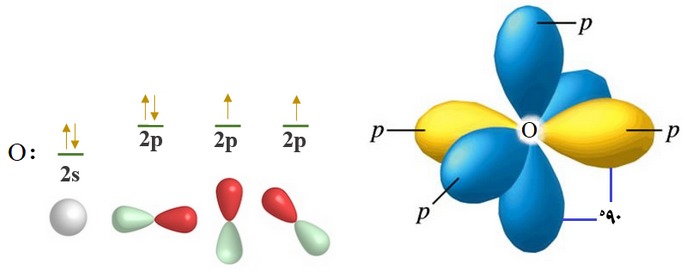
ومن التوزيع الإلكتروني تلاحظ احتواء ذرة الأكسجين على إلكترونين منفردين، وهذا يعني أن عدد الروابط التي يكونها الأكسجين فعلياً يطابق عدد الروابط بناءً على عدد الإلكترونات المنفردة.
إلا أن تمثيل جزيء الماء حسب تداخل الأفلاك البسيطة يتبين أن الزاوية بين الروابط تساوي 90o ، لأن الزاوية بين أفلاك 2p تساوي 90o، وهذا لا يتفق مع الواقع؛ إذ إن الزاوية بين الروابط في جزيء الماء فعلياً هي 104.50 ، وهي قريبة من الزاوية 109.5o في تهجين sp3 ، لذا تم اقتراح تهجين sp3 لذرة الأكسجين.
تساوي ذرة الأكسجين طاقة فلك 2s مع طاقة أفلاك المستوى الفرعي 2p ، وتعمل على خلط تلك الأفلاك لتكوين أربعة أفلاك مهجنة، كل واحدٍ منها يسمى sp3 ، إلا أن فلكين مهجنين منهما يحتويان على زوجين غير رابطين من الإلكترونات، وهذان الزوجان من الإلكترونات يتنافران مع أزواج الإلكترونات الرابطة فيقلل قيمة الزاوية من 109.5o إلى 104.5o.
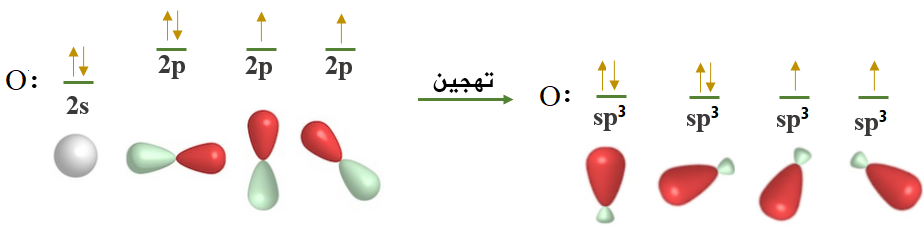
تتجه الأفلاك المهجنة في الفراغ بحيث يكون التنافر بين إلكتروناتها أقل ما يمكن وتأخذ الأفلاك شكلاً منحنياً، والزاوية 104.5o.
ثم تقدّم كل ذرة هيدروجين فلكاً ذرياً من نوع 1s .

- نوع التهجين الذي تجريه ذرة الأكسجين: sp3
- عدد الأفلاك المهجنة في ذرة الأكسجين: 4
- الشكل الهندسي (البنائي) للجزيء: منحني.
- قيمة الزاوية بين الأفلاك المهجنة: 104.5o .
- نوع الأفلاك الداخلة في تكوين الرابطة sp3-s : O-H .
- مبررات التهجين: تفسير الزاوية بين الأفلاك المهجنة.
خلاصة:
الجدول التالي يوضح حالات التهجين:
|
الأفلاك المهجنة |
عدد الأفلاك المهجنة |
الزاوية التقريبية |
عدد أزواج الإلكترونات غير الرابطة على الذرة المركزية |
الاتجاه الفراغي للأفلاك المهجنه |
|
sp |
2 |
180o |
- |
خطي |
|
sp2 |
3 |
120o |
- |
مثلث مستوٍ |
|
sp3 |
4 |
109.5o |
- |
رباعي الأوجه منتظم |
|
107o |
زوج |
هرم ثلاثي |
||
|
104.5o |
زوجين |
منحني |
إعداد : أ. أحمد الحسين
03 / 11 / 2022
النقاشات