أسئلة إضافية
السؤال الأول:
اختر الإجابة الصحيحة لكل فقرة مما يأتي:
1- إذا علمت أن العدد الذري للعنصر X = 9، فإن الأفلاك المكوّنة للرابطة (X-X) هي:
أ) s - s
ب) p - p
ج) sp - sp
د) s - p
2- إذا علمت أن العدد الذري للعنصر A = 7 ، فإن الروابط التي يكونها A في الجزيء A2 هي من نوع:
أ) (1) سيجما، (2) باي.
ب) (3) باي.
ج) (3) سيجما.
د) (1) باي، (2) سيجما.
3- تتكون الرابطة C-H في جزيء CH4 من تداخل الأفلاك:
أ) p - s
ب) p - p
ج) sp3 - s
د) sp3 – sp3
4- تتكون الرابطة N-F في جزيء NF3 من تداخل الأفلاك:
أ) p - p
ب) sp3 - p
ج) p - sp
د) sp3 – sp3
5- إذا علمت أن الزاوية F-P-F في جزيء PF3 هي 1040 ، فإن الأفلاك المكونة للرابطة (P-F):
أ) sp3 - p
ب) sp3 - sp3
ج) sp3 - s
د) p – p
6- الأفلاك التي تستخدمها ذرة الأكسجين O في تكوين الروابط في الجزيء F2O هي:
أ) p
ب) sp3
ج) sp2
د) sp
7- المركب الذي يتخذ الشكل رباعي الأوجه منتظم فيما يأتي هو:
أ) SiCl4
ب) BeF2
ج) OCl2
د) NF3
8- العبارة غير الصحيحة فيما يتعلق بالأفلاك المهجنة هي:
أ) متماثلة في الطاقة.
ب) متماثلة في الشكل.
ج) متماثلة في الاتجاه الفراغي.
د) متماثلة في السعة.
السؤال الثاني:
في ضوء مفهوم التهجين قارن بين BF3 و NH3 من حيث:
أ- التهجين في الذرة المركزية في كل منهما.
ب- الزاوية بين الروابط في كل منهما.
ج- الأفلاك المكوّنة لكل من الرابطتين (N-H) ، (B-F).
د- الشكل الفراغي لكل من الجزيئين.
هـ- وجود أزواج إلكترونات غير رابطة.
و- قطبية الرابطة (N-H) ، (B-F).
السؤال الثالث:
تحتوي الذرة المركزية في الجزيء XF2 على زوجين غير رابطين من الإلكترونات، بينما لا تحتوي الذرة المركزية في الجزيء YF3 على أزواج غير رابطة من الإلكترونات. فإذا كانت الذرتان X , Y تنتميان للدورة الثانية في الجدول الدوري، وأن العدد الذري للفلور = 9، فأجب عن الأسئلة التالية:
- ما نوع التهجين الذي تجريه الذرتان المركزيتان في كلا الجزيئين؟
- ما الشكل البنائي المتوقع لهما؟
- ما نوع الأفلاك المتداخلة في الرابطتين: X-F أم Y-F ؟
- في أي الجزيئين تكون الزاوية بين الروابط أكبر؟
- ما عدد أزواج الإلكترونات غير الرابطة في الجزيء XF2 ؟
- اكتب التوزيع الإلكتروني لذرة Y المهجنة.
السؤال الرابع:
في الجزيئين (H2O , BeH2): (الأعداد الذرية H = 1 ، Be = 4 ، O = 8)
- حدد نوع التهجين الذي تستخدمه ذرة (Be) في الجزيء BeH2 .
- باعتماد التهجين sp3 للذرة (O)، فإنه من المتوقع أن تكون الزاوية H–O-H في الجزيء H2O تساوي 109.50 لكنها في الحقيقة 104.50 . فسر ذلك.
- سمّ الفلكين المشتركين في تكوين الرابطة Be-H في جزيء BeH2 .
- سمّ الشكل الهندسي لكل من الجزيئين: H2O , BeH2 .
السؤال الخامس:
إذا علمت أن التركيب الإلكتروني لذرة العنصر A هو 1s2 2s2 2p1 ولذرة العنصر B هو 1s2 2s2 2p5 . أجب عما يلي:
- اكتب صيغة المركب الناتج من اتحادهما.
- ما نوع التهجين الذي تستخدمه الذرة المركزية؟
- ما الشكل الهندسي للجزيء؟
- ما قيمة الزاوية المتوقع بين روابطه؟
السؤال السادس:
يتحد العنصر 9Y مع كل من العنصرين: 6X ، 8Z ، ليكون مركبين.
اكتب الصيغة الجزيئية لكل من المركبين الناتجين، ثم قارن بينهما من حيث:
- نوع التهجين الذي تستخدمه الذرة المركزية.
- الشكل الهندسي.
- عدد أزواج الإلكترونات غير الرابطة على الذرة المركزية.
السؤال السابع:
قارن بين المركبين (NCl3) و (BCl3) من حيث: (الأعداد الذرية لـ B = 5 ، N = 7 ، Cl = 17).
- شكل الجزيء.
- عدد أزواج الإلكترونات غير الرابطة على الذرة المركزية.
- نوع التهجين للذرة المركزية.
السؤال الثامن:
يرتبط كل من العنصرين Y, X وهما من عناصر الدورة الثانية مع الهيدروجين (ع ذ = 1)، فيتكون مركبين صيغتهما: (YH4, XH3)، باعتماد التهجين sp3 لكلا الذرتين المركزيتين: X , Y أجب عما يأتي:
- ما العدد الذري لكل من العنصرين X , Y ؟
- اكتب التوزيع الإلكتروني للمستوى الأخير للذرة Y بعد التهجين.
- اكتب التوزيع الإلكتروني للمستوى الأخير للذرة X وفق قاعدة هوند.
- سم الشكل الهندسي لكل من الجزيئين (XH3 , YX4).
- ما عدد أزواج الإلكترونات غير الرابطة على الذرة المركزية X؟
- أي الرابطتين أكثر قطبية: (H – X) أم (H – Y)؟
السؤال التاسع:
قارن بين الجزيئين: CCl4 , Cl2O من حيث:
(العدد الذري لـ : C = 6 , O = 8 , Cl = 17)
- نوع التهجين الذي تستخدمه الذرة المركزية.
- عدد أزواج الإلكترونات غير الرابطة على الذرة المركزية.
السؤال العاشر:
حدّد الشكل الفراغي لكلّ من المركبات الآتية:
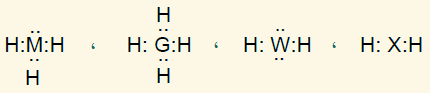
السؤال الحادي عشر:
ما عدد روابط سيجما، وعدد روابط باي في الجزيئات الآتية:
أ- O=C=O
ب- H2C=CH2
ج- H-C≡N
السؤال الثاني عشر:
ما نوع تهجين الذرة المركزية في الجزيئات الآتية:
أ- OF2
ب- NF3
ج- BH3
د- CCl4
السؤال الثالث عشر:
لديك العناصر الافتراضية: 4Z , 15Y , 9T .
اكتب التوزيع الإلكتروني لها، ثم قارن بين الجزيئين YT3 ، و ZT2 من حيث:
أ- نوع التهجين في الذرة المركزية.
ب- شكل الجزيء.
ج- الزاوية بين الروابط.
د- الأفلاك المكونة للرابطتين: Z-T ، و Y-T .
هـ- عدد أزواج الإلكترونات غير الرابطة التي تمتلكها الذرة المركزية.
السؤال الرابع عشر:
فسّر ما يأتي:
أ- بالرغم من أن ذرة الأكسجين تستخدم أفلاك sp3 الهجينة فإن مقدار الزاوية بين الروابط في الجزيء Cl2O هو أقل من 109.50 بقليل.
ب- الرابطة التساهمية من نوع سيجما أقوى من الرابطة التساهمية من نوع باي.
السؤال الخامس عشر:
يرتبط عنصرا (X،Y) (وهما من عناصر الدورة الثانية) بالهيدروجين (ع . ذ = 1)، فيتكون الجزيئان: (YH4 و XH3) بافتراض التهجين sp3 لكلّ من الذرتين المركزيتين: Y ، و X :
أ- ما العدد الذري لذرتي X و Y ؟
ب- سمّ الشكل الهندسي للجزيء YH4 و XH3
ج- ما عدد أزواج الإلكترونات غير الرابطة للذرة المركزية X ؟
د) ما مقدار الزاوية بين الروابط في جزيء YH4 ؟
إعداد : أ. أحمد الحسين
25 / 09 / 2021
النقاشات