الانخفاض في درجة التجمد
Freezing Point Depression
عند تبريد الماء تقل الطاقة الحركية لجزيئاته وتتقارب، وتزداد قوى التجاذب بين دقائقه، فيتحول من الحالة السائلة إلى الحالة الصلبة ويتجمد.
ولكن ماذا يحدث لو أضفنا مذاباً إلى الماء؟
تنتشر جسيمات المذاب بين جسيمات المذيب في المحلول، فتعيق تلك الجسيمات تقارب وتجاذب جسيمات المذيب، فيلزم حينئذ انخفاض أكثر في درجة الحرارة، فتصبح أقل من درجة تجمد المذيب.
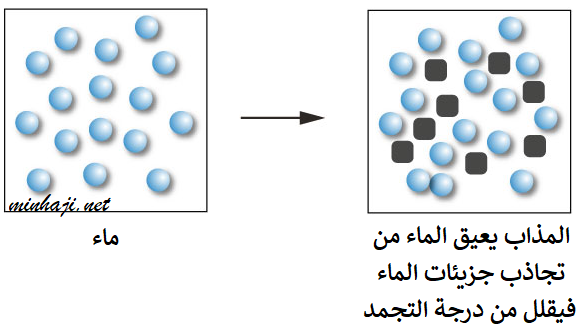
يُسمى الفرق بين درجة تجمد المذيب النقي والمحلول الانخفاض في درجة التجمد.
- عند إذابة 1 mol من السكر (342 g) في 1 Kg من الماء يتجمد المحلول عند درجة -1.86 oC.
- عند إذابة 1 mol من اليوريا (60 g) في 1 Kg من الماء يتجمد المحلول عند درجة -1.86 oC.
وهذا يعني أن إذابة 1 mol من مادة غير متأينة وغير متطايرة في 1 Kg من الماء تنخفض درجة تجمد الماء بمقدار (1.86 oC)، ويمثل هذا المقدار ثابت الانخفاض في درجة تجمد الماء، وهو يتغير بتغير المذيب.
يتناسب الانخفاض في درجة تجمد المحلول طردياً مع النسبة بين عدد جسيمات المذاب وجسيمات المذيب؛ أي تتناسب طردياً مع التركيز المولالي للمحلول.
ويعبر عنه بالصيغة الرياضية كما يأتي:
الانخفاض في درجة التجمد المولالية
المولالية
الانخفاض في درجة التجمد= ثابت × المولالية
Tf = Kf x m
حيث:
Tf: الانخفاض في درجة التجمد.
Kf: ثابت الانخفاض في درجة تجمد المذيب.
m: التركيز المولالي للمحلول.
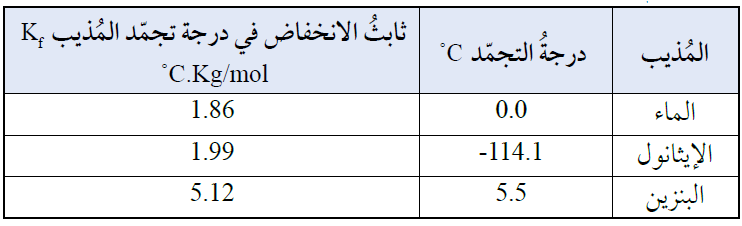
ويوضح الجدول أدناه قيم ثابت الانخفاض في درجة تجمد بعض المذيبات:
مثال:
أحسب درجة تجمد محلول يحتوي على 6.62 g من مادة مذابة في 0.1 kg من الماء المقطر. علمًا أن درجة تجمد الماء 0 oC، وثابت الانخفاض في درجة تجمد الماء = 1.86 oC.Kg/mol، الكتلة المولية للمذاب Mr = 62 g/mol
تحليل السؤال (المعطيات)
كتلة المادة المذابة = 6.62 g
كتلة الماء النقي (المذيب) = 0.1 Kg
ثابت الانخفاض في درجة تجمد الماء = 1.86 oC.Kg/mol
الكتلة المولية للمذاب Mr = 62 g/mol
درجة تجمد الماء النقي = 0 oC
الحل:
نحسب عدد مولات المذاب:
n = = = 0.01 mol
نحسب التركيز المولالي:
m = = = 0.1 molal
نحسب الانخفاض في درجة التجمد:
ΔTf = Kf x m = 1.86 x 0.1 = 0.1860C
درجة تجمد المحلول 0 - 0.186 = -0.186 oC
أتحقق: صفحة (137)
أحسب مقدار الانخفاض في درجة التجمد لمحلول تكون بإذابة 10 g من مادة غير متأينة في 400 g من الإيثانول. علماً أن ثابت الانخفاض في درجة تجمد الإيثانول = 5.12 oC.Kg/mol، الكتلة المولية للمذاب Mr = 46 g/mol
تحليل السؤال (المعطيات)
كتلة المادة المذابة = 10 g
كتلة الماء النقي (المذيب) = 400 g = 0.4 kg
ثابت الانخفاض في درجة تجمد الإيثانول = 5.12 oC.Kg/mol
الكتلة المولية للمذاب Mr = 46 g/mol
الحل:
نحسب عدد مولات المذاب:
n = = = 0.22 mol
نحسب التركيز المولالي:
m = = = 0.55 molal
نحسب الانخفاض في درجة التجمد:
ΔTf = Kf x m = 5.12 x 0.55 = 2.80C
أهمية الانخفاض في درجة التجمد
- في البلدان التي يهطل فيها الثلج في أثناء فصل الشتاء، يرشّ الملح على الطرقات؛ حتى تقل درجة تجمد الماء؛ ما يؤدي إلى منع تراكم الثلوج على الطريق، فيقل خطر انزلاق المركبات التي تسير عليه.
- يعمد سائقو السيارات إلى إضافة مانع تجمد () في مشع السيارة في الأيام التي تنخفض درجة حرارة الجو إلى ما دون الصفر المئوي؛ لمنع حدوث انجماد في الماء الموجود في مشع السيارة.
تدريبات
تدريب (1):
أحسب درجة التجمد لمحلول يحتوي على 12.38 g من السكر C12H22O11 مذاب في 250 g ماء.
تدريب (2):
الصيغة الجزيئية للكبريت الصلب Sx . فإذا علمت أن قيمة الانخفاض في درجة تجمد رابع كلوريد الكربون نتيجة إذابة 0.22 g من الكبريت في 100 g من رابع كلوريد الكربون هي 0.28 oC . ما قيمة x في الصيغة الجزيئية للكبريت.
تدريب (3):
أذيب 99 g من مركب غير أيوني في 669 g ماء، فوجد أن درجة تجمد المحلول الناتج -0.96 oC. أحسب الكتلة المولية للمركب.
تدريب (4):
عينة من مركب مجهول كتلتها 5.5 g، أذيب في 250 g من البنزين فوجد أن درجة تجمد المحلول 1.02 oC تحت درجة تجمد البنزين. أحسب:
- الكتلة المولية للمركب.
- أي الصيغ التالية تمثل المركب المعني C3H3O أم C6H6O2 ؟
إعداد : أ. أحمد الحسين
19 / 02 / 2022
النقاشات