أسئلة المحتوى وإجاباتها
الحموض والقواعد
أتحقق صفحة (12):
1- أصنف المواد الآتية إلى حموض وقواعد وفق مفهوم أرهينيوس:
HClO4 , KOH , HNO3 , HCOOH , Ba(OH)2
حموض أرهينيوس: HClO4 , HNO3 , HCOOH
قواعد أرهينيوس: KOH , Ba(OH)2
2- أكتب معادلة تبين التأثير القاعدي لهيدروكسيد البوتاسيوم KOH .
KOH (s) K+ (aq) + OH- (aq)
أتحقق صفحة (15):
أحدد الزوجين المترافقين في كل من التفاعلين الآتيين:
H2SO3 (aq) + CN- (aq) HSO3- (aq) + HCN (aq)
CH3NH2 (aq) + H2O (l) CH3NH3+ (aq) + OH- (aq)
المعادلة الأولى: (H2SO3/HSO3-) ، (CN-/HCN).
المعادلة الثانية: (CH3NH2/CH3NH3+) ، (H2O/OH-).
أتحقق صفحة (17):
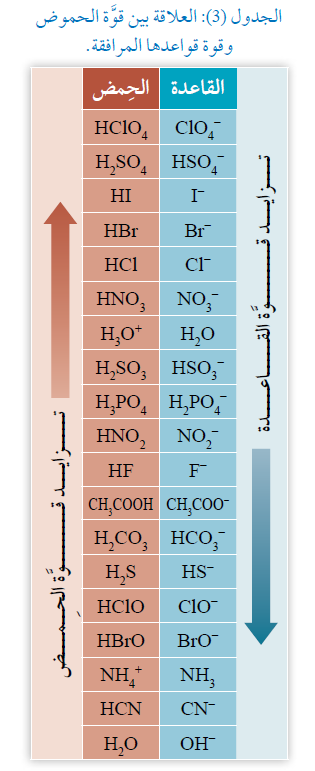 اعتماداً على الجدول (3)، أجيب عن الأسئلة الآتية:
اعتماداً على الجدول (3)، أجيب عن الأسئلة الآتية:
1- أحدد الحمض الأقوى بين الحموض الآتية:
HNO2 , HBr , H2CO3
الحمض الأقوى هو: HBr
2- أحدد أي الحموض الآتية تكون قاعدته المرافقة هي الأقوى:
HI , H2S , HF
الحمض الذي تكون قاعدته المرافقة هي الأقوى: H2S
3- أحدد الجهة التي يزاح نحوها الاتزان في التفاعل الآتي:
HNO2 (aq) + CN- (aq) NO2- (aq) + HCN (aq)
يزاح الاتزان جهة النواتج.
أتحقق صفحة (17):
أكتب معادلتين كيميائيتين أوضح فيهما سلوك الأيون HCO3- مع كل من OH- و HNO2 .
HCO3- + OH- CO32- + H2O
HCO3- + HNO2 H2CO3 + NO2-
أتحقق صفحة (19):
أحدد الحمض والقاعدة حسب مفهوم لويس في كل من التفاعلات الآتية:
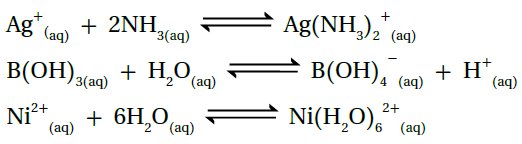
- المعادلة الأولى: الحمض (Ag+)، القاعدة (NH3).
- المعادلة الثانية: الحمض (B(OH)3)، القاعدة (H2O).
- المعادلة الثالثة: الحمض (Ni2+)، القاعدة (H2O).
تجربة (1) صفحة (20):
مقارنة قوة الحموض

التحليل والاستنتاج:
1- أحدد الرقم الهيدروجيني لكل من المحلولين.
الرقم الهيدروجيني لمحلول حمض HCl = 1، الرقم الهيدروجيني لمحلول حمض CH3COOH تقريباً 2.7
2- أحدد المحلول الأكثر قدرة على التوصيل الكهربائي.
محلول حمض HCl ؛ لأنه حمض قوي ويتأين كلياً في الماء، ويُنتج تراكيز عالية من الأيونات.
3- أقارن سرعة تصاعد غاز الهيدروجين في كل من المحلولين.
يتصاعد غاز الهيدروجين بسرعة أكبر من محلول حمض HCl .
4- أحدد الحمض الأقوى والحمض الأضعف.
الحمض الأقوى: حمض HCl ، الحمض الأضعف: CH3COOH
5- أستنتج العلاقة بين قوة الحمض وكل من الرقم الهيدروجيني والتوصيل الكهربائي وسرعة تصاعد الغاز.
بزيادة قوة الحمض تقل قيمة الرقم الهيدروجيني، ويزداد التوصيل الكهربائي لمحلول الحمض، وتزداد سرعة تصاعد غاز الهيدروجين.
إعداد : شبكة منهاجي التعليمية
14 / 08 / 2024
النقاشات