جهد الاختزال المعياري
لا يمكن قياس جهد اختزال قطبٍ ما بمفرده إلا إذا اقترن بنصف تفاعل آخر له جهد معلوم، لذا اتفق العلماء على اتخاذ قطب الهيدروجين المعياري كقطب مرجعي لقياس جهود اختزال العناصر الأخرى، وتم اعتبار جهد اختزاله صفراً في الظروف المعيارية.
2H+ (aq) + 2e- → H2 (g) Eoreduction = 0 V
وتعني Eoreduction في نصف تفاعل الهيدروجين جهد الاختزال المعياري.
كما تم اعتبار جهد تأكسده صفراً في الظروف المعيارية.
H2 (g) → H2 (g) + 2e- Eooxidation = 0 V
وتعني Eooxidation في نصف تفاعل الهيدروجين جهد التأكسد المعياري.
 وقد تم اختيار الهيدروجين كقطب مرجعي لكونه متوسطاً بين العناصر في نشاطه الكيميائي، مما يسهل استخدامه مصعداً أو مهبطاً، اعتماداً على القطب الآخر في الخلية.
وقد تم اختيار الهيدروجين كقطب مرجعي لكونه متوسطاً بين العناصر في نشاطه الكيميائي، مما يسهل استخدامه مصعداً أو مهبطاً، اعتماداً على القطب الآخر في الخلية.
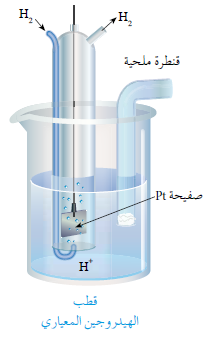
يتكون قطب الهيدروجين المعياري من وعاء يحتوي على صفيحة من البلاتين مغموسة في محلول حمضي تركيز أيون الهيدروجين H+ فيه 1 M ، ويجري ضخ غاز الهيدروجين إلى المحلول عند ضغط للغاز يساوي 1 atm ، وعند درجة حرارة 25 oC .
قد يسلك قطب الهيدروجين المعياري كمهبط مع القطب ذي الجهد المجهول، وحينئذ تُختزل أيونات الهيدروجين في محلوله ويتصاعد غاز الهيدروجين، ويكون القطب المجهول مصعداً فيمتلك جهد اختزال أقل من الهيدروجين (قيمة سالبة).
تحديد جهود الاختزال المعيارية
مثال (1):
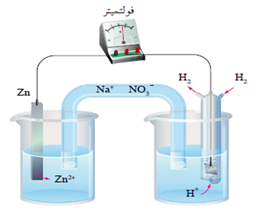
عند عمل خلية جلفانية قطباها من الخارصين والهيدروجين في الظروف المعيارية، تبيّن عملياً ما يلي:
- قراءة الفولتميتر المسجلة 0.76 V
- انحراف مؤشر الفولتميتر باتجاه قطب الهيدروجين.
كم تبلغ قيمة جهد اختزال الخارصين؟
يدل انحراف مؤشر الفولتميتر باتجاه قطب الهيدروجين أن الهيدروجين هو المهبط.
يحسب جهد اختزال الخارصين كالتالي:
E0cell = E0(cathode) – E0(anode)
0.76 V = 0 – Eo(anode)
EoZn = - 0.76 V
وتعني الإشارة السالبة في جهد اختزال الخارصين أن ميل أيونات الخارصين للاختزال أقل من ميل أيونات الهيدروجين.
وعليه يكون نصف تفاعل اختزال الخارصين، وجهد تأكسده كالتالي:
Zn2+ (aq) + 2e- → Zn (s) Eo = -0.76 V
Zn (s) → Zn2+ (aq) + 2e- Eo = +0.76 V
وهذا يعني أن:
E0reduction = - E0oxidation
مثال (2):
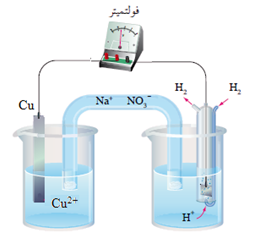
عند عمل خلية غلفانية قطباها من النحاس والهيدروجين في الظروف المعيارية، تبيّن عملياً ما يلي:
- قراءة الفولتميتر المسجلة 0.34 V
- انحراف مؤشر الفولتميتر باتجاه قطب النحاس.
كم تبلغ قيمة جهد اختزال النحاس؟
يدل انحراف مؤشر الفولتميتر باتجاه قطب النحاس أن النحاس هو المهبط.
يحسب جهد اختزال النحاس كالتالي:
Eocell = Eo(cathode) – Eo(anode)
0.34 V = Eo(cathode) – 0
EoCu = + 0.34 V
وتعني الإشارة الموجبة في جهد اختزال النحاس أن ميل أيونات النحاس للاختزال أعلى من ميل أيونات الهيدروجين.
وعليه يكون نصف تفاعل اختزال النحاس، وجهد تأكسده كالتالي:
Cu2+ (aq) + 2e- → Cu (s) Eo = +0.34 V
Cu (s) → Cu2+ (aq) + 2e- Eo = -0.34 V
وبحساب جهود الاختزال لجميع الأقطاب، رتبت في جدول تبعاً لجهود اختزالها يسمى جدول جهود الاختزال المعيارية.
إعداد : أ. أحمد الحسين
29 / 11 / 2022
النقاشات