أسئلة وزارية (التأكسد والاختزال)
الدورات (2001-2005)
الدورة التكميلية 2001
أ- انقل الإجابة الصحيحة للفقرات الآتية إلى دفتر إجابتك.
1) عدد تأكسد (As) في الأيون AsO43- يساوي:
أ- +3
ب- -3
ج- -5
د- +5
2) عند التحليل الكهربائي لمحلول NaCl تركيزه (1 M) باستخدام أقطاب خاملة فإن الذي يتكون عند المهبط:
أ- ذرات Na
ب- Cl2(g)
ج- H+(aq)
د- OH-(aq)
ب- اعتماداً على جهود الاختزال المعيارية لأنصاف التفاعلات المبينة في الجدول المجاور، أجب عما يأتي:

1- ما العنصر الأقوى كعامل مؤكسد؟
Br2
2- ما الفلز الذي يتفاعل مع محلول حمض HCl ويطلق غاز H2 ولا يذوب في أيونات Fe2+ ؟
Ni
3- أي فلزين يكونان خلية جلفانية بأعلى جهد (Eo)؟ احسب جهد الخلية.
Mn/Ag
Eocell = Eo(cathode) – Eo(anode)
Eocell = 0.80 – (-1.18) = 1.98 V
4- هل يمكن حفظ محلول مائي من كبريتات النحاس في وعاء فضة؟ فسر إجابتك اعتماداً على قيمة (Eo) للتفاعل الكلي.
معادلة التفاعل:
CuSO4 + 2Ag → Cu + 2Ag(SO4)2
نلاحظ من التفاعل المراد التنبؤ بحدوثه أن الفضة تأكسد (مصعد)، ويحسب (Eo) للتفاعل كالتالي:
Eocell = Eo(cathode) – Eo(anode)
Eocell = 0.34 – (0.80) = - 0.46 V
وبما أن (Eo) للتفاعل له قيمة سالبة فهذا يعني أن التفاعل لا يحدث بصورة تلقائية؛ إذاً يمكن حفظ المحلول.
ج- وازن معادلة التفاعل الآتي بطريقة نصف التفاعل في وسط قاعدي، ثم حدد كلاً من العامل المختزل والعامل المؤكسد فيها:
NH3 + AlO2- → NO2- + Al
AlO2- + 4H+ + 3e- → Al + 2H2O …… (1)
NH3 + 2H2O → NO2- + 7H+ + 6e- …… (2)
بضرب المعادلة (1) في 2 والمعادلة (2) في 1 وجمع المعادلتين:
2AlO2- + 8H+ + 6e- → 2Al + 4H2O
NH3 + 2H2O → NO2- + 7H+ + 6e-
2AlO2- + NH3 + H+ → 2Al + NO2- + 2H2O
وبإضافة (OH-) إلى طرفي المعادلة:
2AlO2- + NH3 + H+ + OH- → 2Al + NO2- + 2H2O + OH-
وبجمع (OH-) مع (H+):
2AlO2- + NH3 + H2O → 2Al + NO2- + 2H2O + OH-
وبحذف الماء الزائد:
2AlO2- + NH3 → 2Al + NO2- + H2O + OH-
العامل المؤكسد: AlO2-
العامل المختزل: NH3
الدورة الشتوية 2001
أ- انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لكل فقرة من الفقرات الآتية:
1) عدد تأكسد الكبريت (S) يساوي (+2) في:
أ- HSO3-
ب- S2O32-
ج- HS-
د- Na2S
2) إحدى العبارات الآتية تتفق مع الخلية الجلفانية:
أ- قيمة ْE للخلية سالبة.
ب- تنتقل الإلكترونات فيها من المهبط إلى المصعد.
ج- إشارة المصعد سالبة.
د- يحدث تفاعل التأكسد عند المهبط.
3) عند التحليل الكهربائي لمحلول كلوريد الصوديوم باستخدام أقطاب جرافيت تكون النواتج كما يأتي:
أ- هيدروجين وأكسجين.
ب- هيدروجين وكلور.
ج- صوديوم وأكسجين.
د- صوديوم وكلور.
ب-  يبين الجدول المجاور القيم المطلقة لجهود الاختزال المعيارية للعناصر: C , B , A .
يبين الجدول المجاور القيم المطلقة لجهود الاختزال المعيارية للعناصر: C , B , A .
وقد لوحظ عند وصل نصف الخلية A مع نصف الخلية B، أن الإلكترونات تنتقل من B إلى A، كما لوحظ عند وصل نصف الخلية A مع قطب الهيدروجين المعياري أن الإلكترونات تنتقل من A إلى قطب الهيدروجين. وأن أيونات C2+ تؤكسد العنصر B. اعتماداً على المعلومات السابقة، أجب عما يأتي:
1- اكتب إشارة (Eo) لكل نصف من أنصاف تفاعلات الاختزال السابقة.
A (-0.14) , B (-0.40) , C (+85)
2- اكتب التفاعل الكلي الذي يحدث في الخلية الجلفانية المكونة من القطبين A ، C ، ثم حدد سريان الإلكترونات في الدارة الخارجية، واحسب (Eo) لهذه الخلية.
A + C2+ → A2+ + C
تتحرك الإلكترونات من قطب A إلى قطب C .
Eocell = Eo(cathode) – Eo(anode)
Eocell = 0.85 – (-0.14) = 0.99 V
3- رتب العناصر: C , B , A حسب قوتها كعوامل مختزلة.
B > A > C
ج- مّر تيار كهربائي في خلية تحليل كهربائي تحوي مصهوراً لمادة MgCl2 . اكتب معادلة التفاعل الحادث عند المصعد.
2Cl- → Cl2 + 2e-
د- يتم التفاعل الآتي في وسط حمضي:
MnO4- + CH3CH2OH → Mn2+ + CH3COOH
وازن المعادلة بطريقة نصف التفاعل ثم حدد العامل المؤكسد والعامل المختزل في التفاعل.
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O …… (1)
CH3CH2OH + H2O → CH3COOH + 4H+ + 4e- …… (2)
بضرب المعادلة (1) في 4 والمعادلة (2) في 5 وجمع المعادلتين:
4MnO4- + 32H+ + 20e- → 4Mn2+ + 16H2O
5CH3CH2OH + 5H2O → 5CH3COOH + 20H+ + 20e-
5CH3CH2OH + 4MnO4- + 12H+→ 5CH3COOH + 4Mn2+ + 11H2O
العامل المؤكسد: MnO4-
العامل المختزل: CH3CH2OH
دورة 2001
أ- انقل الإجابة الصحيحة للفقرة الآتية إلى دفتر إجابتك.
إذا كان التفاعل الآتي يحدث في إحدى الخلايا الجلفانية: Mn(s) + Cd2+(aq) → Mn2+(aq) + Cd(s) فإن:
أ- القطب Cd هو القطب السالب
ب- كتلة القطب Mn تزداد
ج- الإلكترونات تسري من القطب Cd إلى القطبMn
د- تركيز أيونات Mn2+ يزداد
ب- يتم التفاعل الآتي في وسط حمضي:
Sb2S3 + NO3- → Sb2O5 + S + NO
1- وازن المعادلة بطريقة نصف التفاعل.
NO3- + 4H+ + 3e- → NO + 2H2O …… (1)
Sb2S3 + 5H2O → Sb2O5 + 3S + 10H+ + 10e- …… (2)
بضرب المعادلة (1) في 10 والمعادلة (2) في 3 وجمع المعادلتين:
10NO3- + 40H+ + 30e- → 10NO + 20H2O
3Sb2S3 + 15H2O → 3Sb2O5 + 9S + 30H+ + 30e-
10NO3- + 3Sb2S3 + 10H+ → 3Sb2O5 + 9S + 10NO + 5H2O
2- حدد العامل المؤكسد في التفاعل.
NO3-
3- ما عدد تأكسد العنصر Sb في المركب Sb2O5 ؟
+5
ج- تم استخدام كل فلز من الفلزات الآتية (G , D , C , B , A) مع محلول أحد أملاحه المائية بتركيز (1 M) لعمل خلية جلفانية مع النيكل (Ni) ومحلول أحد أملاحه المائية بتركيز (1 M) وكانت النتائج كما في الجدول المجاور:
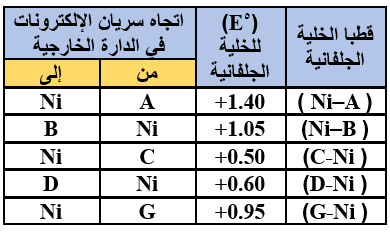
اعتماداً على المعلومات المبينة في الجدول أجب عما يأتي:
1- رتب الفلزات السابقة متضمنة النيكل في سلسلة كهركيميائية حسب قوتها كعوامل مختزلة (من الأكثر نشاطاً إلى الأقل نشاطاً).
A > G > C > Ni > D > B
2- هل يمكن حفظ محلول أحد أملاح الفلز C في وعاء من الفلز D؟
يمكن.
3- احسب فرق الجهد (oE) للخلية الجلفانية التي يتكون قطباها من الفلزين (D , B) ثم حدد اتجاه سريان الإلكترونات في الدارة الخارجية للخلية الجلفانية.
Eocell = Eo(cathode) – Eo(anode)
Eocell = 1.05 – (0.60) = 0.45 V
تتحرك الإلكترونات من قطب D إلى قطب B .
د- مّر تيار في خلية التحليل الكهربائي للماء باستخدام حمض الكبريتيك H2SO4 وأقطاب من البلاتين.
اكتب المعادلة الموزونة للتفاعل الذي يحدث عند المصعد.
2H2O → O2 + 4H+ + 4e-
الدورة الصيفية 2002
أ- انقل إلى دفتر إجابتك الفقرة الآتية والإجابة الصحيحة لها:
1) عند اختزال أيون البيرمنغنات (MnO4-) إلى (MnO2)، فإن التغير في عدد تأكسد (Mn) يساوي:
أ- 1
ب- 3
ج- 4
د- 5
2) عند التحليل الكهربائي لمحلول NaI تركيزه (1 M) باستخدام أقطاب بلاتين، فإن نواتج التحليل هي:
أ- O2 + I2
ب- Na + I2
ج- O2 + H2
د- H2 + I2
ب- ادرس الجدول أدناه الذي يبين جهود الاختزال المعيارية لعدد من أنصاف التفاعلات، ثم أجب عن الأسئلة الآتية:

1- اكتب معادلة التفاعل الكلي الذي يحدث في خلية جلفانية مكونة من قطبي Zn , Ni ثم احسب قيمة (EoCell).
Zn + Ni2+ → Zn2+ + Ni
Eocell = Eo(cathode) – Eo(anode)
Eocell = -0.23 – (-0.76) = 0.53 V
2- حدد المصعد والمهبط وشحنة كل منهما في الخلية السابقة.
المصعد: Zn ، وشحنته سالبة، المهبط: Ni ، وشحنته موجبة.
3- حدد اتجاه سريان الإلكترونات في الدارة الخارجية للخلية السابقة.
من قطب Zn إلى قطب Ni .
4- حدد أقوى عامل مؤكسد وأقوى عامل مختزل من أنصاف التفاعلات المبينة في الجدول.
أقوى عامل مؤكسد: Cr2O72- ، أقوى عامل مختزل: Zn
5- هل يمكن حفظ محلول من الدايكرومات (Cr2O72-) في وعاء من النيكل؟ فسر إجابتك.
لا يمكن؛ لأن جهد اختزال وعاء النيكل أقل.
ج- عند تمرير تيار كهربائي في خلية تحليل كهربائي تحتوي على محلول CuBr2 :
اكتب نصف تفاعل اختزال أيونات النحاس Cu2+ .
Cu2+ + 2e- → Cu
د- وازن معادلة التفاعل الآتي بطريقة نصف التفاعل في وسط حمضي. ثم حدد العامل المؤكسد، والعامل المختزل فيها:
ICl → IO3- + I2 + Cl-1
ICl + 3H2O → IO3- + Cl- + 6H+ + 4e- …… (1)
2ICl + 2e- → I2 + 2Cl- …… (2)
بضرب المعادلة (1) في 1 والمعادلة (2) في 2 وجمع المعادلتين:
ICl + 3H2O → IO3- + Cl- + 6H+ + 4e-
4ICl + 4e- → 2I2 + 4Cl-
5ICl + 3H2O → IO3- + 2I2 + 5Cl- + 6H+
العامل المؤكسد: ICl
العامل المختزل: ICl
الدورة الشتوية 2003
أ- انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لكل فقرة من الفقرات الآتية:
1) عند تحليل محلول مائي من كلوريد البوتاسيوم (KCl) تركيزه (1 M) كهربائياً باستخدام أقطاب جرافيت يكون الناتج عند المصعد:
أ- O2(g)
ب- K(s)
ج- Cl2(g)
د- H2(g)
2) إحدى العبارات الآتية غير صحيحة فيما يتعلق بخلية التحليل الكهربائي وهي:
أ- شحنة المصعد موجبة.
ب- جهد الخلية (Eo) له قيمة سالبة.
ج- يحدث تفاعل اختزال عند المهبط.
د- تتجه الأيونات الموجبة نحو المصعد.
ب- يبين الجدول المجاور جهود الاختزال المعيارية لعدد من أنصاف التفاعلات. اعتماداً على ما في الجدول، أجب عما يأتي:
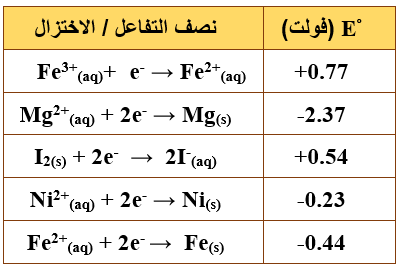
1- حدد أقوى عامل مختزل وأقوى عامل مؤكسد في الجدول المجاور.
أقوى عامل مؤكسد: Fe3+
أقوى عامل مختزل: Mg
2- اكتب معادلة التفاعل الكلي الذي يحدث في الخلية الجلفانية المكونة من القطبين (Mg، Fe)، ثم احسب قيمة (Eo) للخلية.
Mg + Fe2+ → Mg2+ + Fe
Eocell = Eo(cathode) – Eo(anode)
Eocell = -0.44 – (-2.37) = 1.93 V
3- حدد اتجاه سريان الإلكترونات في الدارة الخارجية للخلية الجلفانية السابقة.
تتحرك الإلكترونات من قطب (Mg) إلى قطب (Fe).
4- هل يمكن حفظ اليود I2(s) في وعاء من النيكل (Ni)؟ وضح إجابتك باستخدام جهود الاختزال.
لا يمكن؛ لأن جهد اختزال الوعاء أقل.
ج- يتم التفاعل الآتي في وسط حمضي:
As2S3 + NO3- → AsO43- + SO42- + NO
1- وازن معادلة التفاعل بطريقة نصف التفاعل.
NO3- + 4H+ + 3e- → NO + 2H2O …… (1)
As2S3 + 20H2O → 2AsO43- + 3SO42- + 40H+ + 28e- …… (2)
بضرب المعادلة (1) في 28 والمعادلة (2) في 3 وجمع المعادلتين:
28NO3- + 112H+ + 84e- → 28NO + 56H2O
3As2S3 + 60H2O → 6AsO43- + 9SO42- + 120H+ + 84e-
28NO3- + 3As2S3 + 4H2O → 6AsO43- + 9SO42- + 28NO + 8H+
2- حدد العامل المؤكسد والعامل المختزل في التفاعل.
العامل المؤكسد: NO3-
العامل المختزل: As2S3
3- ما عدد تأكسد العنصر As في الأيون AsO43- ؟
+5
إعداد : شبكة منهاجي التعليمية
10 / 01 / 2023
النقاشات