أسئلة وزارية (التأكسد والاختزال)
الدورات (2010-2008)
الدورة الشتوية 2008
أ- انقل إلى دفتر إجابتك الفقرات الآتية والإجابة الصحيحة لها:
1) عدد تأكسد الأكسجين في المركب OF2 يساوي:
أ- -2
ب- -1
ج- +1
د- +2
2) إحدى العبارات الآتية صحيحة فيما يتعلق بخلية التحليل الكهربائية:
أ- شحنة المصعد سالبة.
ب- جهد الخلية قيمته سالبة.
ج- يحدث تفاعل التأكسد على المهبط.
د- تتجه الأيونات الموجبة نحو المصعد.
ب- يمثل الجدول الآتي جهود الاختزال المعيارية لعدد من أنصاف التفاعلات، ادرسه جيداً ثم أجب عن الأسئلة التي تليه:
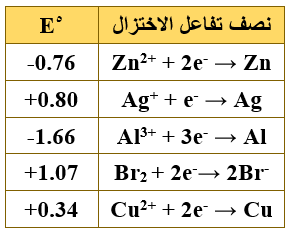
حدّد:
1) أضعف عامل مختزل.
Br-
2) الفلزان اللذان يكونان خلية جلفانية لها أقل جهد ممكن.
Ag/Cu
3) العناصر التي تستطيع تحرير الهيدروجين من مركباته.
Al , Zn
ج- بالاعتماد على نفس الجدول إذا تم تشكيل خلية جلفانية قطباها من (Al و Cu) في الظروف المعيارية أجب عما يأتي:
1) احسب جهد الخلية المعيارية.
Eocell = Eo(cathode) – Eo(anode)
Eocell = 0.34 – (- 1.66) = + 2.00 V
2) اكتب التفاعل الكلي للخلية.
2Al + 3Cu2+ → 2Al3+ + 3Cu
3) حدّد العامل المؤكسد.
Cu2+
4) ماذا يحدث لكتلة قطب الألمنيوم مع مرور الزمن؟
تقل.
5) إذا كانت القنطرة الملحية تحتوي محلول KNO3 ، فإلى أي من الوعائين تتجه أيونات NO3- ؟
إلى وعاء الألمنيوم.
6) إلى أي الأقطاب تتجه الإلكترونات في الخلية السابقة؟
إلى قطب النحاس.
د- لديك معادلة التفاعل الآتي:
Sb2S3 + NO3- Sb2O5 + S + NO
1- اكتب المعادلة النهائية الموزونة بطريقة (أيون إلكترون).
10NO3- + 3Sb2S3 + 10H+ → 3Sb2O5 + 9S + 10NO + 5H2O
2- ما عدد الإلكترونات المكتسبة أو المفقودة في التفاعل السابق؟
30
الدورة الصيفية 2008
أ) عند دراسة الفلزات المشار إليها بالرموز الافتراضية الآتية (E , D , C , B , A) وجميعها تكون أيونات ثنائية موجبة، تم الحصول على النتائج الآتية:
- يستطيع العنصر A اختزال أيونات العنصر D ولا يستطيع اختزال أيونات العنصر B .
- لا يمكن تحضير العنصر D من أملاحه بواسطة العنصر C .
- يتأكسد العنصر C عند وضعه في محلول يحتوي أيونات العنصر E .
- تستطيع أيونات العنصر C أكسدة العنصر D ولا تستطيع أكسدة العنصر E .
معتمداً على النتائج السابقة أجب عما يأتي:
1) رتّب الفلزات السابقة تصاعدياً حسب قوتها كعوامل مختزلة.
B > A > D > C > E
2) أي فلزين يكوّنا خلية جلفانية لها أكبر جهد ممكن؟
B , E
3) أي الفلزات يمكن أن يصنع منها أوعية لحفظ محاليل أملاح العنصر D ؟
C , E
4) عند بناء خلية جلفانية قطباها من العنصرين C و D اكتب معادلة نصف التفاعل عند كل من المهبط والمصعد.
نصف التفاعل الذي يحدث عند المصعد:
C2+ + 2e- → C
نصف التفاعل الذي يحدث عند المهبط:
D → D2+ + 2e-
ب) 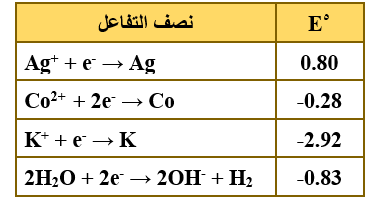 يمثل الجدول المجاور جهود الاختزال المعيارية بالفولت لعدد من أنصاف التفاعلات. أجب عن الأسئلة الآتية:
يمثل الجدول المجاور جهود الاختزال المعيارية بالفولت لعدد من أنصاف التفاعلات. أجب عن الأسئلة الآتية:
1) حدّد أقوى عامل مؤكسد.
Ag+
2) أي العناصر يستطيع تحرير غاز H2 من محاليله الحمضية المخففة؟
Co , K
3) هل يمكن تحضير عنصر الكوبالت Co من محاليل أملاحه باستخدام التحليل الكهربائي؟
نعم يمكن.
4) احسب Eo للخلية الجلفانية المكونة من Ag و Co .
Eocell = Eo(cathode) – Eo(anode)
Eocell = 0.80 – (-0.28) = 1.08 V
ج) إذا أمكن التحليل الكهربائي لمحلول هيدريد البوتاسيوم KH اكتب التفاعل الذي يحدث عند كل من المهبط والمصعد. ثم اكتب التفاعل الكلي.
التفاعل الذي يحدث عند المصعد:
2H- → H2 + 2e-
التفاعل الذي يحدث عند المهبط:
2H2O + 2e- → H2 + 2OH-
التفاعل الكلي:
2H2O + 2H- → 2H2 + 2OH-
د) اكتب المعادلة التي تحدث عند المهبط عند التحليل الكهربائي لمصهور Al2O3 .
Al3+ + 3e- → Al
هـ) وازن بخطوات المعادلة الكيميائية الآتية بطريقة نصف التفاعل في وسط قاعدي:
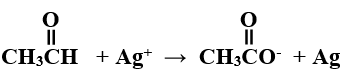
Ag+ + e- → Ag …… (1)
C2H4O + H2O → C2H3O2- + 3H+ + 2e- …… (2)
بضرب المعادلة (1) في 2 والمعادلة (2) في 1 وجمع المعادلتين:
2Ag+ + 2e- → 2Ag
C2H4O + H2O → C2H3O2- + 3H+ + 2e-
C2H4O + H2O + 2Ag+ → C2H3O2- + 2Ag + 3H+
وبإضافة (3OH-) إلى طرفي المعادلة:
C2H4O + H2O + 2Ag+ + 3OH- → C2H3O2- + 2Ag + 3H+ + 3OH-
وبجمع (OH-) مع (H+):
C2H4O + H2O + 2Ag+ + 3OH- → C2H3O2- + 2Ag + 3H2O
وبحذف الماء الزائد:
C2H4O + 2Ag+ + 3OH- → C2H3O2- + 2Ag + 2H2O
و) حدّد العامل المختزل والعامل المؤكسد في المعادلة الآتية:
2H2O2 → 2H2O + O2
العامل المؤكسد: H2O2
العامل المختزل: H2O2
إعداد : شبكة منهاجي التعليمية
10 / 01 / 2023
النقاشات