موزانة المعادلات في وسط حمضي
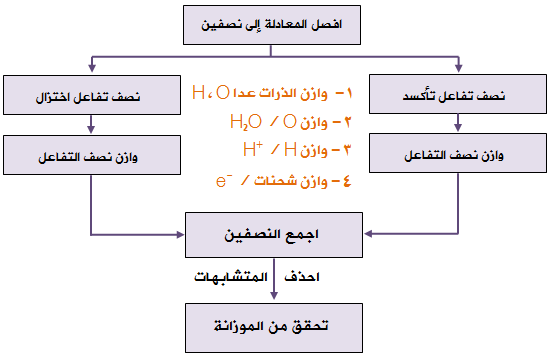
خطوات موازنة معادلات التأكسد والاختزال بطريقة نصف التفاعل والتي تتم في الوسط الحمضي:
1- أقسم المعادلة إلى نصفين يدل أحدهما على التأكسد والآخرعلى الاختزال.
2- أجري الخطوات التالية على كل نصف:
أ- أوازن ذرات العناصر ما عدا الأكسجين والهيدروجين.
ب- أوازن ذرات الأكسجين بإضافة عدد من جزيئات الماء إلى الطرف الذي يعاني نقصاً في ذرات الأكسجين.
ج- أوازن ذرات الهيدروجين بإضافة عدد من أيونات (H+) إلى الطرف الذي يعاني نقصاً في ذرات الهيدروجين.
د- أوازن الشحنات الكهربائية بإضافة عددٍ من الإلكترونات لأحد طرفي المعادلة بحيث يصبح المجموع الجبري للشحنات على طرفي المعادلة متساوٍ.
3- أساوي عدد إلكترونات نصف تفاعل التأكسد بعدد إلكترونات نصف تفاعل الاختزال بالضرب التبادلي إن لزم الأمر.
4- أجمع نصفي التفاعل (اختصر الإلكترونات من الطرفين، ويمكن اختصار الماء وأيونات الهيدروجين).
5- أتحقق من صحة الموازنة بموازنة الذرات والشحنات.
6- أتأكد أن المعادلة الكلية الموزونة مكتوبة بأبسط صورة.
مثال (1):
أوازن المعادلة الآتية بطريقة نصف التفاعل في الوسط الحمضي:
Cr3+ + NO3- Cr2O72- + HNO2 →
الحل:
أقسم المعادلة إلى نصفين:
Cr2O72- → Cr+3
→ NO3- HNO2
أختار أحد نصفي المعادلة وأوازنه باتباع الخطوات الآتية:
Cr2O72- → Cr+3
أوازن الذرات ما عدا الأكسجين والهيدروجين؛ أي ذرات (Cr):
Cr2O72- → 2Cr+3
أوازن الأكسجين بإضافة (7H2O) إلى الطرف الأيمن من المعادلة:
Cr2O72- → 2Cr+3 + 7H2O
أوازن الهيدروجين بإضافة (14H+) إلى الطرف الأيسر من المعادلة:
Cr2O72- + 14H+ → 2Cr+3 + 7H2O
أحسب شحنات كل طرف بضرب عدد المولات في الشحنة الظاهرة على كل مادةن بضرب عدد مولات كل مادة في الشحنة الظاهرة:
Cr2O72- + 14H+ → 2Cr+3 + 7H2O
ألاحظ أن مجموع الشحنات على يسار المعادلة (+12)، وعلى يمينها (+6)؛ لذا أوازن الشحنات بإضافة (6e-) إلى الطرف الأيسر من المعادلة:
Cr2O72- + 14H+ + 6e- → 2Cr+3 + 7H2O
وبما أن الإلكترونات قد أضيفت إلى يسار المعادلة، فالمعادلة تمثل نصف تفاعل اختزال.
نصف المعادلة الثاني:
→ NO3- HNO2
أوازن الذرات ما عدا الأكسجين والهيدروجين؛ أي ذرات (N)، وألاحظ أنها موزونة:
→ NO3- HNO2
أوازن الأكسجين بإضافة (H2O) إلى الطرف الأيسر من المعادلة:
HNO2 + H2O → NO3-
أوازن الهيدروجين بإضافة (3H+) إلى الطرف الأيمن من المعادلة:
HNO2 + H2O → NO3- + 3H+
أحسب شحنات كل طرف بضرب عدد المولات في الشحنة الظاهرة على كل مادة:
HNO2 + H2O → NO3- + 3H+
ألاحظ أن مجموع الشحنات على يسار المعادلة (0)، وعلى يمينها (+2)؛ لذا أوازن الشحنات بإضافة (2e-) إلى الطرف الأيمن من المعادلة:
→ NO3- + 3H+ + 2e- HNO2 + H2O
وبما أن الإلكترونات قد أضيفت على يمين المعادلة، فالمعادلة تمثل نصف تفاعل تأكسد.
ولمساواة عدد الإلكترونات المكتسبة بعدد الإلكترونات المفقودة نضرب معادلة التأكسد في (3)، ومعادلة الاختزال في (1):
(Cr2O72- + 14H+ + 6e- → 2Cr+3 + 7H2O) x 1
→ NO3- + 3H+ + 2e-) x 3 (HNO2 + H2O
فيصبح عدد الإلكترونات المكتسبة يساوي عدد الإلكترونات المفقودة.
Cr2O72- + 14H+ + 6e- → 2Cr+3 + 7H2O
→ 3NO3- + 9H+ + 6e- 3HNO2 + 3H2O
أحذف الإلكترونات من الطرفين، وأختصر المتشابهات (H2O) و (H+)، وأجمع المعادلتين:
Cr2O72- + 3HNO2 + 5H+ → 2Cr+3 + 3NO3- + 4H2O
مثال (2):
يتم التفاعل الآتي في وسط حمضي، أجيب على الأسئلة التي تليه:
Cr3+ + CO2 Cr2O72- + C2H6O →
- وازن المعادلة بطريقة نصف التفاعل.
- حدد العامل المؤكسد.
- ما عدد تأكسد الكروم في الأيون (Cr2O72-)؟
- ما عدد الإلكترونات المكتسبة أو المفقودة في التفاعل السابق؟
- كم مولاً من Cr2O72- يلزم لأكسدة مول واحد من C2H6O ؟
الحل:
1- أقسم المعادلة إلى نصفين:
Cr2O72- → Cr+3
→ CO2 C2H6O
أختار أحد نصفي المعادلة وأوازنه باتباع الخطوات الآتية:
Cr2O72- → Cr+3
أوازن الذرات ما عدا الأكسجين والهيدروجين؛ أي ذرات (Cr):
Cr2O72- → 2Cr+3
أوازن الأكسجين بإضافة (7H2O) إلى الطرف الأيمن من المعادلة:
Cr2O72- → 2Cr+3 + 7H2O
أوازن الهيدروجين بإضافة (14H+) إلى الطرف الأيسر من المعادلة:
Cr2O72- + 14H+ → 2Cr+3 + 7H2O
أحسب شحنات كل طرف بضرب عدد المولات في الشحنة الظاهرة على كل مادةن بضرب عدد مولات كل مادة في الشحنة الظاهرة:
Cr2O72- + 14H+ → 2Cr+3 + 7H2O
ألاحظ أن مجموع الشحنات على يسار المعادلة (+12)، وعلى يمينها (+6)؛ لذا أوازن الشحنات بإضافة (6e-) إلى الطرف الأيسر من المعادلة:
Cr2O72- + 14H+ + 6e- → 2Cr+3 + 7H2O
وبما أن الإلكترونات قد أضيفت إلى يسار المعادلة، فالمعادلة تمثل نصف تفاعل اختزال.
نصف المعادلة الثاني:
→ CO2 C2H6O
أوازن الذرات ما عدا الأكسجين والهيدروجين؛ أي ذرات (C):
→ 2CO2 C2H6O
أوازن الأكسجين بإضافة (H2O) إلى الطرف الأيسر من المعادلة:
C2H6O + 3H2O → 2CO2
أوازن الهيدروجين بإضافة (12H+) إلى الطرف الأيمن من المعادلة:
C2H6O + 3H2O → 2CO2 + 12H+
أحسب شحنات كل طرف بضرب عدد المولات في الشحنة الظاهرة على كل مادة:
C2H6O + 3H2O → 2CO2 + 12H+
ألاحظ أن مجموع الشحنات على يسار المعادلة (0)، وعلى يمينها (+12)؛ لذا أوازن الشحنات بإضافة (12e-) إلى الطرف الأيمن من المعادلة:
C2H6O + 3H2O → 2CO2 + 12H+ + 12e-
وبما أن الإلكترونات قد أضيفت على يمين المعادلة، فالمعادلة تمثل نصف تفاعل تأكسد.
بضرب نصف التفاعل التأكسد في (1)، ونصف تفاعل الاختزال في (2):
(C2H6O + 3H2O → 2CO2 + 12H+ + 12e-) x 1
2Cr3+ + 7H2O) x 2 → Cr2O72- + 6e- + 14H+)
تصبح المعادلتين:
C2H6O + 3H2O → 2CO2 + 12H+ + 12e-
4Cr3+ + 14H2O → 2Cr2O72- + 12e- + 28H+
وبحذف الإلكترونات والمواد الزائدةن وجمع المعادلتين:
2Cr2O72- + C2H6O + 16H+ → 4Cr3+ + 2CO2 + 11H2O
التحقق من موازنة الشحنات:

2- العامل المؤكسد: Cr2O72-
3- عدد تأكسد الكروم = +6
4- (12) إلكترون.
يلزم (2) مول.
سؤال 1 :
يتم التفاعل الآتي في وسط حمضي، أجب على الأسئلة التي تليه:
As2O3 + NO3- → H3AsO4 + NO
- وازن المعادلة بطريقة نصف التفاعل (أيون - إلكترون).
- حدد العامل المؤكسد.
- حدد العامل المختزل.
- ما عدد تأكسد الزرنيخ As في كل من As2O3 و H3AsO4 ؟
- ما مقدار التغير في عدد تأكسد الزرنيخ؟
سؤال 2 :
يتم التفاعل الآتي في وسط حمضي، أجب على الأسئلة التي تليه:
MnO4- + ClO3- → Mn2+ + ClO4-
- اكتب نصف تفاعل التأكسد موزوناً.
- اكتب نصف تفاعل الاختزال موزوناً.
- حدد العامل المختزل.
- ما عدد مولات الإلكترونات المكتسبة أو المفقودة في التفاعل؟
- ما مقدار التغير في عدد تأكسد المنغنيز؟
سؤال 3 :
يتم التفاعل الآتي في وسط حمضي، أجب على الأسئلة التي تليه:
NO2 → NO + NO3-
- وازن المعادلة بطريقة نصف التفاعل (أيون - إلكترون).
- حدد العامل المؤكسد.
سؤال 4 :
يتم التفاعل الآتي في وسط حمضي، أجب على الأسئلة التي تليه:
IPO4 → I2 + IO3- + H2PO4-
- وازن المعادلة بطريقة نصف التفاعل.
- حدد العامل المختزل في التفاعل.
سؤال 6 :
التفاعل الآتي يحدث في وسط حمضي:
Zn + NO3- → Zn2+ + NH4+
- ما صيغة العامل المؤكسد في التفاعل؟
- ما عدد تأكسد النيتروجين في NH4+ ؟
- اكتب المعادلة الموزونة لنصف تفاعل التأكسد.
- اكتب المعادلة الموزونة لنصف تفاعل الاختزال.
إعداد : شبكة منهاجي التعليمية
31 / 01 / 2023
النقاشات