توصيل محاليل المركبات ومصاهيرها التيار الكهربائي
المواد الكهرلية والمواد غير الكهرلية
تصنف المواد حسب توصيل محاليلها ومصاهيرها للتيار الكهربائي إلى صنفين:

المواد الكهرلية
وهي المواد التي توصيل محاليلها ومصاهيرها للتيار الكهربائي؛ لأنها تتفكك في الماء أو بالحرارة إلى أيونات موجبة وسالبة حرة الحركة في جميع الاتجاهات وباتجاه الأقطاب المخالفة لها في الشحنة.
أمثلة على المواد الكهرلية
الأملاح
الأملاح مركبات أيونية تتفكك في الماء أو بالحرارة إلى أيونات موجبة وسالبة.
فمثلاً، يتفكك ملح كلوريد الصوديوم NaCl في الماء بحسب المعادلة الآتية:
NaCl(s) Na+(aq) + Cl-(aq)
الحموض
تتفكك الحموض في الماء إلى أيونات موجبة وسالبة.
فمثلاً، يتفكك حمض HCl في الماء بحسب المعادلة الآتية:
HCl(g) H+(aq) + Cl-(aq)
القواعد
تتفكك القواعد في الماء إلى أيونات موجبة وسالبة.
فمثلاً، يتفكك هيدرويد البوتاسيوم KOH في الماء بحسب المعادلة الآتية:
KOH(s) K+(aq) + OH-(aq)
المواد غير الكهرلية
وهي المواد التي لا توصل محاليلها المائية أو مصاهيرها التيار الكهربائي.
مثال على المواد غير الكهرلية
المركبات الجزيئية، وهي مواد تتكوّن من جزيئات متعادلة، وتبقى متعادلة عند صهرها أو إذابتها في الماء، كالسكر.
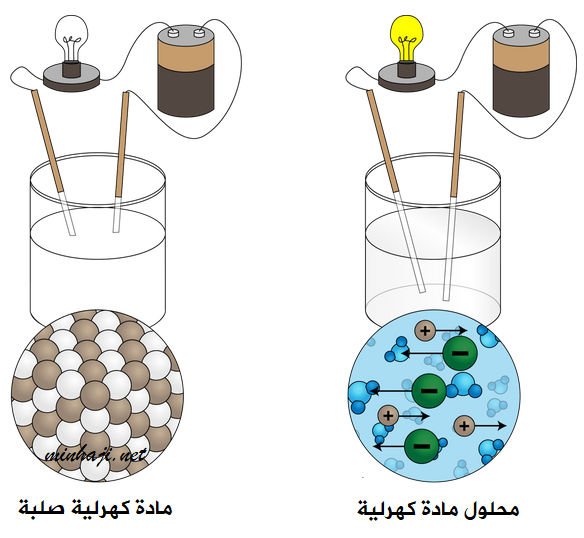
توصيل محاليل ومصاهير المواد الكهرلية للتيار
يؤدي صهر المواد الكهرلية أو إذابتها في الماء إلى تحرر أيوناتها؛ وتصبح حرة الحركة فتوصل التيار الكهربائي.
أما في حالة المواد الكهرلية الصلبة، فإن أيوناتها تكون مقيدة، فلا توصل التيار الكهربائي.
إعداد : شبكة منهاجي التعليمية
30 / 03 / 2025
النقاشات