أسئلة المحتوى وإجاباتها
أتحقق صفحة (82):
1- ما العلاقة بين طاقة التبخر المولية للسائل وقوى التجاذب بين جزيئاته؟
تزداد طاقة التبخر المولية للسائل بزيادة قوى التجاذب بين جزيئاته.
2- أرتب السوائل الآتية تصاعدياً تبعاً لتزايد سرعة تبخرها:
CH3CH3 , CH3OH , CH3Cl
CH3OH < CH3Cl < CH3CH3
أفكر صفحة (82):
يمثل الشكل توزيع الطاقة الحركية لجزيئات السائلين A و B عند درجة حرارة معينة.
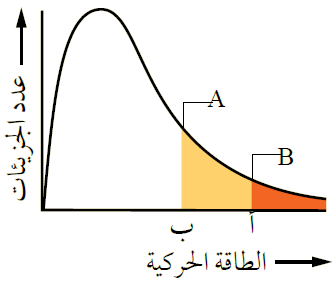
- ماذا تمثل كل من النقطتين أ و ب ؟
(أ) الحد الأدنى من الطاقة اللازمة للتغلب على قوى التجاذب بين جزيئات السائل B فيتبخر.
(ب) الحد الأدنى من الطاقة اللازمة للتغلب على قوى التجاذب بين جزيئات السائل A فيتبخر.
- أي السائلين أسرع تبخراً عند درجة الحرارة نفسها؟
السائل أسرع تبخراً؛ لأن الحد الأدنى من الطاقة اللازمة لتبخره أقل.
أفكر صفحة (83):
أفسر، مستعيناً بالشكل الآتي:

الحروق الناجمة عن بخار الماء أشدّ من تلك الناجمة عن الماء الساخن عند درجة حرارة 1000C.
نلاحظ من المنحنى ارتفاع درجة حرارة الماء نتيجة تسخينه حتى 1000C ثم ثبات هذه الدرجة لفترة من الزمن مع استمرار التسخين، فيمتص الماء مزيداً من الطاقة الحرارية للتغلب على قوى التجاذب بين جزيئاته متحولاً إلى بخار الماء، أي أن بخار الماء يختزن كمية من الطاقة الحرارية أكبر من تلك التي يختزنها الماء عند 1000C وعند تكاثفه فإنه يطلقها مسبباً حروقاً أشد من تلك التي يسببها الماء على درجة حرارة 1000C .
أتحقق صفحة (83):
ما شروط حدوث عملية التكاثف؟
انخفاض درجة الحرارة، وتقارب الجزيئات.
أفكر صفحة (85):
أفسر تزايد الضغط البخاري للسائل بزيادة درجة حرارته.
يزداد الضغط البخاري بزيادة درجة الحرارة وذلك لزيادة عدد الجزيئات التي تمتلك الحد الأدنى من الطاقة اللازمة للتبخر فتزداد سرعة التبخر ويزداد عدد الجزيئات المتبخرة والمؤثرة في وحدة المساحة من سطح السائل فيزداد الضغط البخاري.
أرتب السوائل الآتية حسب تزايد ضغطها البخاري عند درجة الحرارة نفسها:
CH3F ، CH3OH ، CH3CH3
CH3CH3 > CH3F > CH3OH
أتحقق صفحة (85):
مستعيناً بالشكل (18)، أحدد الضغط البخاري لكل من ثلاثي كلوروميثان والماء عند درجة 500C ، وأقارنها بقيمة ضغطه البخاري الواردة في الجدول (2). ماذا أستنتج؟
الضغط البخاري لثلاثي كلوروميثان: 500 mmHg
الضغط البخاري للماء: 100 mmHg
عند مقارنة الضغط البخاري لكلا المادتين عند 500 و 200 ألاحظ أنه كلما زادت درجة الحرارة زاد الضغط البخاري للسائل.
أفكر صفحة (86):
أحدد أي السائلين NH3 أم HF له أعلى درجة غليان؟
HF ؛ لأن قوى التجاذب بين جزيئاته أقوى.
أتحقق صفحة (86):
- أحدد، اعتماداً على الجدول (3)، درجة غليان الماء عندما يبلغ ضغطه البخاري 355mmHg .
درجة غليان الماء: 800C
- اعتماداً على الشكل (18)، أحدد درجة غليان العادية ثلاثي كلوروميثان وثنائي إيثيل إيثر.
درجة غليان العادية لثلاثي كلوروميثان: 61.30C
درجة غليان العادية لثنائي إيثيل إيثر: 34.60C
إعداد : شبكة منهاجي التعليمية
13 / 11 / 2021
النقاشات