أثر التركيز في سرعة التفاعل (قانون سرعة التفاعل)
وجد عملياً أن سرعة التفاعل تتناسب طردياً مع تراكيز المواد المتفاعلة مرفوعة لقوى معينة تمثل رتبة التفاعل.
التفاعل العام التالي يمثل تحلل المادةA :
A → B
حيث x هي رتبة التفاعل بالنسبة إلى المادة A ، ويمكن أن تكون قيمتها صفراً ، 1 ، 2 ، 3 أو قيمة كسرية، ويتم تعيين قيمتها عملياً.

وتعبر رتبة التفاعل عن العلاقة بين تضاعف تركيز المادة وتضاعف سرعة التفاعل.
رتبة التفاعل: قيمة عددية صحيحة أو كسرية، تبين أثر التركيز في سرعة التفاعل وتعتمد على طريقة سير التفاعل، ويمكن حسابها من التجربة العملية.
|
رتبة التفاعل |
تضاعف التركيز |
تضاعف السرعة |
|
0 |
مرتان |
تبقى ثابتة |
|
3 مرات |
تبقى ثابتة |
|
|
4 مرات |
تبقى ثابتة |
|
|
1 |
مرتان |
مرتان |
|
3 مرات |
3 مرات |
|
|
4 مرات |
4 مرات |
|
|
2 |
مرتان |
4 مرات |
|
3 مرات |
9 مرات |
|
|
4 مرات |
16 مرة |
ويمكن تحديد رتبة التفاعل من العلاقة:
( تضاعف التركيز )X = تضاعف السرعة
x : رتبة التفاعل بالنسبة لإحدى المواد المتفاعلة.
سؤال:
كم تبلغ رتبة التفاعل للمادة Z في تفاعل ما إذا تضاعف تركيزها:
- (3) مرات، وتضاعفت السرعة (3) مرات.
- مرتان، وتضاعفت السرعة (8) مرات.
- (4) مرات، وتضاعفت السرعة مرتان.
- (7) مرات، وبقيت السرعة ثابتة.
وبالعودة للعلاقة:

وبتحويل العلاقة السابقة إلى مساواة نحصل على العلاقة التالية:

k : ثابت سرعة التفاعل، وتختلف وحدته باختلاف رتبة التفاعل.

ويمكن التعبير عن القانون العام لسرعة التفاعل إذا اشتمل التفاعل على أكثر من مادة متفاعلة على النحو التالي:
A + B → C
وبتحويل العلاقة السابقة إلى مساواة نحصل على العلاقة التالية:
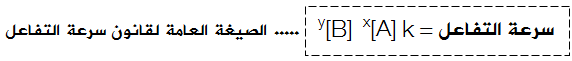
حيث:
x : رتبة التفاعل بالنسبة للمادة A .
y : رتبة التفاعل بالنسبة للمادة B .
ويسمى المجموع (x + y ) بالرتبة الكلية للتفاعل أو رتبة التفاعل.
رتبة التفاعل الكلية: مجموع الرتب بالنسبة للمواد المتفاعلة.
إعداد : أ. أحمد الحسين
07 / 02 / 2019
النقاشات
mo
اجابة السوال
إضافة رد
0 ردود